ضربالمثل معروف لویی پاستور که میگوید: «شانس تنها اذهان آماده و مستعد را یاری میدهد» یک سادهسازی رومانتیک از رابطه بین شانس و کشفیات علمی است. خوشبختانه ممکن است ما بیش از یک شانس داشته باشیم و به کمک تعاملاتمان در محافل علمی، اذهان ما میتوانند برای همکاری در کشف یک یافته جدید، آماده شوند؛ بنابراین کشف هپسیدین- هورمون تنظیمکننده آهن- یک موهبت غیرمنتظره بود.
من بهعنوان دانشجوی فوق دکتری، نقش آنتیبیوتیکهای پپتیدی اندوژن را در فعالیت ضدمیکروبی فاگوسیتها مطالعه کردهام. من و همکارانم خانوادهای از پپتیدهای ضدمیکروبی فاگوسیتها، یعنی دفنسینها را کشف و توصیف کردیم که در نهایت در گروه دفنسینهای ترشحشده از سطوح اپیتلیال قرار گرفت. در دهه ۱۹۹۰، دفنسینهای مجرای ادراری تناسلی انسان به موضوع اصلی تحقیقات من تبدیل شد. اشکال غالب، واریانتهایی از دفنسین انسانی-۱ (HBD-۱) بودند که در انتهای– N برش خورده بودند و با استفاده از تکنیک وسترن بلاتی که از آنتیبادیهای تولیدشده در آزمایشگاه ما بهره میبرد، شناسایی شدند.
اریکا والوره، یکی از محققان حاضر در آزمایشگاه من، متوجه شد پپتیدی بارها و بارها در بین واریانتهای HBD-۱ ظاهر میشود که توسط آنتیبادی ضد HBD-۱ مورد شناسایی قرار نمیگیرد. به ابتکار او، ما مقدار کافی از این پپتید ۲۵ آمینواسیدی را تخلیص کردیم تا توالی آن را تعیین کرده و آن را با یک mRNA از کبد که مشخصات آن تعیین نشده بود، مطابقت دهیم. این پپتید همانند دفنسینها، یک پپتید آمفیپاتیک کاتیونی بود، اما از نظر ساختاری متمایز و بهجای ۳ پیوند دیسولفیدی حاوی ۴ پیوند بود. به دلیل سنتز کبدی و فعالیت ضد میکروبی آن در شرایط آزمایشگاهی، ما آن را هپسیدین نامگذاری کردیم. در ژانویه سال ۱۹۹۸، توالی آن را به پایگاه داده SWISS-PROT ارسال کردیم و دوباره به مطالعه بتا دفنسینها مشغول شدیم. در یک جلسه پیرامون ایمنی ذاتی در شهر کلمار در سپتامبر ۱۹۹۹، با الیویه لورال و پیر بریسوت، متخصصان شناختهشده در زمینه پاتوژنز هموکروماتوز ارثی آشنا شدم و آنها در مورد اهداف من از مطالعه هپسیدین سؤال کردند، اما من به آنها گفتم که بسیار درگیر دفنسینها هستم.
بعداً آنها این خبر هیجانانگیز را به من دادند که متوجه شدهاند mRNA هپسیدین موشی در کبد موشهای مبتلا به گرانباری آهن، القا میشود. ما برای انتشار مقاله خودمان و مقاله آنها در مورد هپسیدین در یک شماره از Journal of Biological Chemistry با یکدیگر همکاری کردیم. در همین زمان، آزمایشگاه دیگری از طریق غربالگری اولترافیلتر پلاسمای انسانی، همان پپتید را کشف کرد و ثابت کرد که در خون گردش میکند؛ اما شانس هنوز با هپسیدین یار نبود. گروه دیگری متشکل از گائل نیکولاس و سوفی وولونت، عملکرد فاکتور رونویسی ظاهراً نامربوط USF۲ را توصیف کردند و متوجه شدند موش فاقد USF۲ دارای پانکراس غیرمعمول تیره (dark) است؛ یافتهای که در نهایت به گرانباری آهن سیستمیک نسبت داده شد. قبلاً مشخص شده بود که USF۲ بلافاصله در کنار ژن هپسیدین تنظیمکننده آهن قرار دارد.
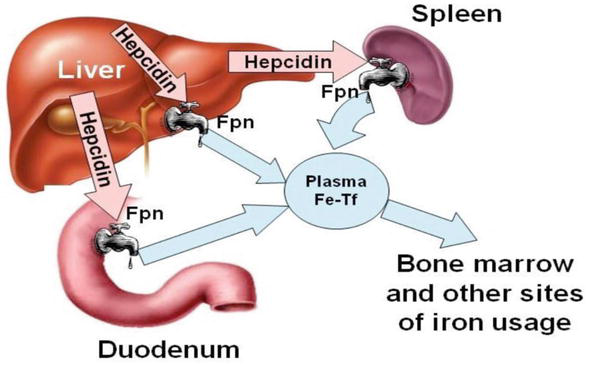
بهطور اتفاقی، روش حذف اختصاصی USF۲، باعث از دست رفتن بیان هپسیدین نیز شد و فنوتیپ چشمگیر حاصله باعث آغاز یک کار تحقیقاتی بینالمللی شد که قویاً هپسیدین را بهعنوان هورمون تنظیمکننده آهن معرفی و اختلال در تنظیم آن را بهعنوان علت اختلالات رایج آهن عنوان کرد. با بهره بردن از قدرت مطالعات موازی در مورد انواع مختلف اختلالات انسانی آهن و مدلهای سلولی و موشی آنها، این حیطه به یک معدن طلای علمی برای آزمایشگاه من و بسیاری دیگر تبدیل شده است. هپسیدین بهعنوان تنظیمکننده اصلی جذب رودهای آهن و ذخیره و توزیع آهن در بدن معرفی شده است. این پپتید با اتصال به گیرنده منحصربهفرد خود یعنی فروپورتین که تنها خارجکننده شناختهشده (اکسپورتر) آهن سلولی است، عمل میکند و از این طریق عملکرد آن در خروج آهن به پلاسما را مهار میکند.
هپسیدین بهنوبه خود، توسط غلظتهای آهن موجود در پلاسما و آهن ذخیرهشده در کبد، تحت تنظیم فیدبکی قرار میگیرد. بهطور غیرمنتظرهای، تنظیم هپسیدین توسط آهن شامل یک مسیر گیرنده مورفوژنتیک استخوانی جدید میشود که با چند مولکول آداپتور و حداقل ۲ سنسور آهن یعنی گیرندههای ترانسفرین ۱ و ۲ میانکنش دارد. هپسیدین بهواسطه التهاب و عمدتاً توسط سیتوکین IL-۶ القا میشود و نشان داده شده است که برای ایمنی ذاتی در برابر باکتریهای گرم منفی ضروری است. سرانجام اینکه مشخص شد هپسیدین مطابقت تأمین آهن با نیازهای اریتروپوئز بهعنوان اصلیترین مصرفکننده آهن در بدن را میانجیگری میکند. هپسیدین در این نقش خود توسط اریتروفرون، یک هورمون جدید، دیگر تنظیم میشود که توسط پیشسازهای اریتروئیدی فعالشده با اریتروپوئتین در مغز استخوان تولید میشود.
در نهایت، هپسیدین خود را بهعنوان هورمونی چندمنظوره نشان داده است که در اصل متابولیسم آهن را هماهنگ کرده و پاسخ آن را به استرسهایی مانند کمبود آهن غذایی، عفونت، خونریزی و بارداری میانجیگری میکند. اختلال در تنظیم هپسیدین بهعنوان عامل بسیاری از اختلالات آهن از جمله کمخونی ناشی از التهاب، هموکروماتوز ارثی و گرانباری آهن در کمخونیهایی با اریتروپوئز غیرمؤثر شناخته شده و باعث تحریک گسترش بسیاری از کاربردهای تشخیصی و درمانی گردیده است.
فراپژوهش