خلاصه
تستهای آزمایشگاهی جهت تشخیص و پایش آسیب و بیماریهای کبد بسیار مهم هستند. تستهای کبدی که در حال حاضر با سنجش مارکرهای پلاسمایی مورد استفاده واقع میشوند، چهار دسته میباشند:
- مارکرهای بررسی کننده آسیب کبد (مثل آمینوترانسفرازها، گاماگلوتامیل ترانسفراز و آلکالن فسفاتاز)
- مارکرهای عملکرد کبد (مثل زمان پروترومبین و بیلیروبین)
- مارکرهای هپاتیتهای ویروسی
- مارکرهای پرولیفراسیون (مثل آلفا فتوپروتئین)
در میان مارکرهای بررسی کننده آسیب کبد، آلانین و آسپارتات آمینوترانسفراز ( ALTو AST) بهطور وسیعی مورد استفاده قرار میگیرند، معالوصف تفسیر تغییرات ALT و AST ممکن است پیچیده باشد. علاوه بر این هر دوی این آنزیمها در پیشگویی سرانجام آسیب حاد کبد و نارسایی کبد ضعیف هستند. بیومارکرهای جدید کبدی به سرعت در حال ایجاد و توسعه هستند و FDA و آژانس پزشکی اروپا هر دو اعلام کردهاند که از استفاده از برخی بیومارکرهای جدید در کارآزماییهای دارویی حمایت خواهند کرد. هدف از این مقاله، مرور تاریخچه بیومارکرهای کبدی، خلاصه کردن مکانیسمها و تفسیر افزایش ALT و AST در آسیبهای کبد (بهویژه آسیب حاد) و بحث درخصوص بیومارکرهای جدیدی میباشد که ممکن است در آینده جایگزین ALT و AST گردند.
مقدمه
تستهای آزمایشگاهی در تشخیص بیماریهای کبد و افتراق عوامل ایجادکننده آن حائز اهمیت هستند. آزمایشهای فعلی کبد را بهطور اجمال میتوان به سه گروه تقسیمبندی کرد:
- آنهایی که عملکرد کبد را نشان میدهند.
- آنهایی که آسیب کبد را نمایان میسازند
- سرولوژی هپاتیتهای ویروسی
آزمایشهای بررسی عملکرد کبد شامل تستهای انعقادی (مانند PT، INR)، بیلیروبین سرم و پروتئین سرم (توتال یا آلبومین) میباشد. آزمایشهای آسیب کبدی مشتمل بر آلانین آمینوترانسفراز سرم (ALT)، آسپارتات آمینوترانسفراز (AST)، آلکالن فسفاتاز (ALP)، گاماگلوتامیل ترانسفراز (GCT)، لاکتات دهیدروژناز (LDH) و گاهی گلوتامات دهیدروژناز (GLDH) میگردند. آلفافتوپروتئین (AFP) تنها بیومارکری است که میتوان آن را در گروه چهارم طبقهبندی نمود و بیانگر پرولیفراسیون هپاتوسیتها (هپاتوسلولار کارسینوما، رژنراسیون کبد) میباشد. از میان مارکرهای آسیب کبد، ALT و AST بیشتر از بقیه در زمینه تشخیص و کارهای تحقیقاتی کاربرد دارند، اما درخصوص استفاده صحیح و تفسیر این آمینوترانسفرازها ابهاماتی وجود دارد. علاوه بر این یافتههای جدید حاکی از محدودیتهای آمینوترانسفرازهای سرم در تشخیص زودهنگام آسیب کبد و نیز پیشبینی سرانجام بیمار میباشد. در سالهای اخیر تعداد زیادی از بیومارکرهای آسیب کبدی شناسایی شدهاند که بسیاری از آنها قابلیت این را دارند که جایگزینِ آمینوترانسفرازهای سرم شوند و یا حداقل در کنار آنها به کار گرفته شوند. پیشرفتهای فراوانی در ایجاد بیومارکرهای جدید مکانیستیک، مارکرهای التهابی، بیومارکرهای خارج سلولی مبتنی بر RNA و سایر بیومارکرها ایجاد شده است. پیشنهاد شده که تعدادی از این بیومارکرها در آینده نزدیک جایگزین بیومارکرهای فعلی شوند و یا اینکه در کنار آنها مورد استفاده واقع شوند. FDA و آژانس پزشکی اروپا (EMA) حمایت خود را از سازمانهای مختلفی که علاقهمند به توسعه بیومارکرهای جدید برای بررسی آسیبهای کبدی ناشی از دارو هستند، اعلام کردهاند. بنابراین خوب است که مروری بر بیولوژی و کارکرد بالینی آمینوترانسفرازها، مکانیسم افزایش آنها در سرم و تفسیر صحیح آن داشته باشیم و نگاهی نیز به آینده بیومارکرها در عرصه تشخیص و پایش آسیبهای کبدی بیندازیم.
واکنشهایی که توسط آمینوترانسفرازها کاتالیز میشوند
ALT و AST هر دو انتقال یک گروه آمین را از یک اسیدآمینه به آلفاکتوگلوتارات کاتالیز میکنند. اسیدهای آمینه موردنظر ال- آلانین و ال– آسپارتات هستند و محصولات واکنش به ترتیب ال- گلوتامات و پیروات یا اگزالات میباشند (شکل ۱). نتیجه نهایی، تعویض یک گروه آمین و یک گروه کتو میباشـــد. پیریدوکسال ۵′- فسفات (PLP، از مشتقات ویتامین B۶) در هر دو واکنش بهعنوان کوآنزیم فعالیت میکند. باید بدانیم که هر دوی این واکنشها برگشتپذیر هستند. علاوه بر نقش این دو آنزیم در متابولیسم اسیدهای آمینه، عملکردهای فیزیولوژیک مختلف دیگری نیز برای آنها وجود دارد؛ بهعنوان مثال این آنزیمها در هوموستاز انرژی نقش مهمی دارند. مسلماً مهمترین نقش ALT در سیکل آلانین– گلوکز میباشد (شکل B۱). در عضلات، ALT با استفاده از گروه آمین گلوتامات، پیروات را به اسیدآمینه آلانین تبدیل میکند. این آلانین وارد گردش خون شده و در کبد جذب میشود، سپس توسط ALT موجود در هپاتوسیتها میتواند به پیروات تبدیل شده و در ساخت گلوکز بکار رود. این سیستم بهویژه در زمانهایی که بدن تحت شرایط استرس است همچون زمان گرسنگی یا ورزش شدید در تنظیم گلوکز اهمیت مییابد. همچنین گفته شده که ایزوفرم میتوکندریایی ALT در گلوکونئوژنز در برخی موارد اهمیت خاص دارد. مهمترین عملکرد فیزیولوژیک AST حفظ نسبت +NADH/NAD در سلول میباشد. AST عامل تعیینکننده در تبادل مالات- آسپارتات میباشد که NADH را در سیتوزول اکسید کرده و +NAD را در داخل میتوکندری احیا مینماید که این توالی نهایتاً منجر به گلیکولیز و انتقال الکترون میشود (شکلc ۱)
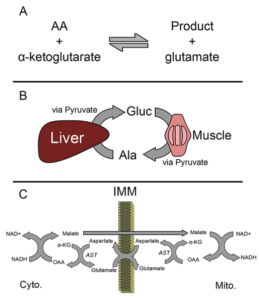
Figure ۱: Functions of ALT and AST. (A) Both
alanine and aspartate aminotransferases (ALT
and AST, respectively) catalyze the conversion
of alpha-ketoglutarate (a-KG) and an amino acid
to glutamate and another product. In the case of
ALT, the amino acid and product are alanine and
pyruvate. In the case of AST, the amino acid and
product are aspartate and oxaloacetate (OAA).
(B) The glucose-alanine cycle. (C) The malateaspartate
shuttle. IMM, inner mitochondrial membrane.
خلاصهای از تاریخچه آزمایشهای بالینی کبد
قبل از اینکه سنجش آنزیمهای کبد متداول شود، ارزیابی سلامت کبد با امتحانات بالینی (زردی، درد شکم) و آزمایشهای پرزحمت و زمانبر کبد انجام میشد، بعنوان مثال اندازهگیری بیلیروبین از اوایل ۱۹۱۳ با استفاده از واکنش Van den Berg معمول شد. پاکسازی رنگهایی همچون برموسولفتالئین، و نیز تشکیل متابولیتهای ترکیباتی مانند اسید بنزوئیک، قرینهای بر توانایی کبد در متابولیزه کردن و دفع گزانتوبیوتیکها بود. تست تحمل گالاکتوز، توانایی کبد را در تبدیل گالاکتوز به گلیکوژن ارزیابی میکرد. فلوکولاسیون نمونه (سرم) پس از مخلوط کردن با معرف خاصی نظیر ترکیبات سفالین کلسترول که از مغز گوسفند تهیه شده بود میتوانست تغییرات پروتئینهای سرم را که ناشی از اختلال عملکرد کبد بود مشخص کند. در همین رابطه سنجش زمان انعقاد هم قابل انجام بود. متأسفانه بیشتر این آزمایشها زمانبر بودند و در مورد بسیاری از بیماریهای کبدی کاربرد نداشتند. علاوه بر این، ظرفیت عملی بالای کبد و قدرت بازسازی آن مانع میشد که تا قبل از اینکه بیماری بسیار پیشرفت کند نتایج این آزمایشها غیرطبیعی گردند. بنابراین حساسیت بیشتر این آزمایشها بسیار محدود بود.
اگرچه آلکالن فسفاتاز را در اوایل ۱۹۳۰ میتوانستند اندازهگیری کنند اما تغییرات سایر آنزیمهای کبد از جمله آمینوترانسفرازها تا سالها بعد قابلاندازهگیری نبود. در آن موقع اعتقاد بر این بود که آنزیمهای داخل سلولی به ارگانلهای سلولی متصل شدهاند و حتی پس از تخریب غشاء سلول، قابل آزاد شدن نیستند. تنها سماجت یک پزشک بود که باعث شد با امکانات محدود و به کمک یک دانشجو این فرضیه را رد کند.
Karmenو همکارانش (۱۹۵۵) برای اولین بار افزایش AST و ALT را در آسیب کبد گزارش کردند. آنها افزایش آمینوترانسفرازها را در یک بیمار با هپاتیت حاد و دو بیمار با سیروز کبد در اوایل دهه ۱۹۵۰ مشاهده نمودند. آنها بهویژه علاقهمند بودند که افزایش این آنزیمها را در انفارکتوس میوکارد بررسی کنند اما مشاهده کردند که در بیماریهای دیگر نیز افزایش این آنزیمها مشاهده میشــــود. در همان زمانها De Ritis و همکارانش (۱۹۵۵) افزایش این آنزیمها را در سرم افراد مبتلا به هپاتیت نشان دادند.
در ابتدا اندازهگیری آمینوترانسفرازها زمانبر بود. در مطالعات Karmen و همکارانش (۱۹۵۵)، برای جدا کردن گلوتامات تولیدشده توسط واکنش این آنزیمها با آلفاکتوگلوتارات و آلانین یا آسپارتات از کروماتوگرافی کاغذی استفاده میشد، سپس نقاط گلوتامات از روی کاغذ بریده شده و گلوتامات آن استخراج میگردید و با روش کالریمتری اندازهگیری میشد. Karmen و همکارانش (۱۹۵۵) در حاشیه مطالعات خود، برای سنجش AST روش دو آنزیمی را بکار گرفتند که پایه بسیاری از روشهای جدید سنجش این آنزیم شد.
اندکی بعد آزمایش مشابهی برای ALT ساخته شد. در آزمایش قبلی اگزالواستات که توسط AST تولید شده بود توسط مالات دهیدروژناز به مالات احیا میشد که طی آن NADH به مصرف میرسید. در مورد ALT، پیرواتی که توسط ALT تولید شده بود توسط LDH احیا میشد و به این ترتیب NADH مصرف میگردید. کاهش NADH در طی زمان را میشد با کاهش جذب نوری در nm۳۴۰ مشخص کرد و از آن برای محاسبه فعالیت آنزیم استفاده نمود. استفاده از روش واکنش با دو آنزیم شدیداً میزان زمان موردنیاز برای اندازهگیری آنزیمها را کاهش داد.
سنجش ترانسآمینازها بهزودی مورد استقبال آزمایشگاههای بالینی واقع شد. اگرچه تجربیات بعدی نشان داد که AST همواره در بیماریهای کبد افزایش مییابد اما ALT شاخص بهتری برای بررسی آسیب کبد میباشد چراکه برخلاف AST فعالیت آن در کبد بهمراتب بیشتر از عضلات است. در مجموع ویژگی ALT برای کبد و در دسترس بودن روش نسبتاً سریع برای سنجش آن، باعث شد که در کارهای بالینی مورد استقبال قرار گیرد. از زمان ورود ALT و AST به حیطه کاربرد بالینی بهجز GGT که در دهه ۱۹۶۰ بکار گرفته شد، تغییر عمدهای در بیومارکرهای کبدی به وجود نیامد، درحالیکه در مورد سایر اعضا همچون قلب بیومارکرهای متعددی معرفی شد (شکل ۲).
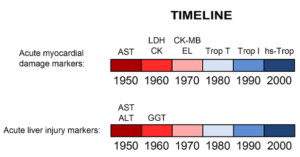
Figure ۲: Timeline of biomarker development for
both acute myocardial injury and liver injury
(۱۹۵۰ – ۲۰۱۰).
AST, aspartate aminotransferase
ALT, alanine aminotransferase
LDH, lactate dehydrogenase
GGT, gamma-glutamyl transpeptidase
CK, creatine kinase
CK-MB, creatine kinase-MB (myocardial isoform)
EL, electrophoresis for LDH and CK
Trop, troponin
Hs-Trop, high sensitivity troponin
مکانیسمها و تغییر افزایش ALT و AST
باور عمومی بر این است که افزایش آمینوترانسفرازها در نتیجه انهدام سلول و تخریب غشاء آن میباشد. شاهد این مدعا این است که مقدار ALT سرم بعد از تیمار با القاءکنندههای آپوپتوز هپاتوسیتها اندک است، اما در طی دوره آسیب افزایش مییابد. مرگ آپوپتوتیک سلولها را میتوان یک انهدام کنترلشده سلولی فرض کرد که طی آن حداقل پروتئینهای داخل سلولی به فضای بیرون راه مییابند، اما نکروز انکوتیک در واقع ا نفجاری کنترل نشده است که در برخی سلولها پس از آپوپتوز روی میدهد.
نشانههای آپوپتوز (چروکیدگی سلول، تراکم کروماتین، ایجاد جسم آپوپتوتیک)در مدلهای آپوپتوز در هپاتوسیتها در مراحل اولیه آسیب قابل مشاهده هستند و این در حالی است که هنوز افزایش چشمگیری در میزان ALT مشاهده نمیشود.
در مرحله بعدی که هپاتوسیتها بهطور مستقیم یا در اثر التهاب آسیب میبینند، مقدار ALT بشدت افزایش مییابد. اگرچه به نظر میرسد که تخریب غشاء سلول و نشت پروتئین مهمترین عامل افزایش ALT در سرم است، اما شواهدی مبنی بر دخالت سایر مکانیسمها هم وجود دارند (جدول ۱).
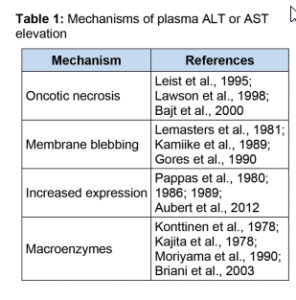
گفته میشود در هنگام آسیب Ischemia- reperfusion کبد، حبابهایی در سطح غشاء سلولی ایجاد میشوند که محتوی اجزای سیتوزولی هستند و با ترکیدن این حبابها بدون اینکه مرگ سلولی اتفاق بیفتد آمینوترانسفرازها آزاد میشوند. بخشی از این ادعا مستند به بررسیهای میکروسکوپی است و قسمت دیگر مبتنی بر این یافته است که ایزوفرم سیتوزولی AST در ابتدای صدمه به سلول آزاد میشود، اما ایزوفرم میتوکندریایی در مراحل بعدی آسیب سلولی آزاد شده و متناسب با وسعت نکروز کبد میباشد.
عامل دیگری که به افزایش سطح سرمی آمینوترانسفرازها در برخی موارد کمک میکند القای تولید و بیان آنهاست. مشخص شده که در برخی موارد داروهای القاکننده آنزیم میکروزومال نظیر الکل، بیان بافتی و سطح سرمی GGT را افرایش میدهند. کارهای تجربی در موشها هم نشان دادهاند که با تجویز تتراکلرید کربن (ccl۴) مقدار ALT و AST افزایش مییابد که این خود نشانگر افزایش بیان آنها میباشد. پس از آن افزودن سیکلوهگزامید که مهارکننده سنتز پروتئین است موجب کاهش شدید مقدار سرمی این آنزیمها میشود. نکته مهم این است که تجویز سیلکوهگزامید باعث افزایش بقای حیوان نمیشود و این موضوع نشان میدهد که کاهش سطح ترانسآمینازها نشانگر حفاظت در برابر ccl۴ نمیباشد.
پیشنهاد شده است که افزایش سطح سرمی ALT و AST پس از تیمار با ccl۴ میتواند ناشی از رژنراسیون سلولهای کبد باشد، اما شواهد اندکی در این خصوص ارائه شده است. در مجموع این یافتهها نشان میدهند که حتی افزایش بسیار زیاد سطح سرمی ترانسآمینازها میتواند تا حدودی ناشی از القاء بیان آنها باشد.
حداقل دو مکانیسم برای بیان ALT پیشنهاد شده است. در طی چند دهه این نکته موردتوجه بود که برخی از بیماران که فیبرات مصرف میکنند مقدار ALT سرم آنها افزایش مییابد بیآنکه علامتی وجود داشته باشد. فیبراتها آگونیستهای Peroxisome- Proliferator- Activated Receptor- a (PPARa) هستند.
با توجه به مطلب مذکور این فرضیه شکل گرفت که PPARa بیان ALT و AST را تنظیم میکند. تجویز فنوفیبرات، ایزوفرمهای سیتوزولیک هر دو آنزیم را در سلولهای هپاتومای انسان افزایش میدهد که این اتفاق تأییدی بر فرضیه مذکور میباشد. جالب است بدانیم که فنوفیبرات بیان آمینوترانسفرازهای سیتوزولیک را در موشها کاهش میدهد و این اثر در کمبود PPARa از بین میرود. این موضوع علاوه بر اینکه اهمیت نقش PPARa را در بیان آمینوترانسفرازها نشان میدهد، بیانگر تفاوت بینگونهای (انسان و موش) در پاسخ به آگونیستهای PPARa نیز میباشد. بعدها مشخص شد که ایزوفرمهای سیتوزولیک و میتوکندریایی ALT ( ALT۱و ALT۲) هم در انسان و هم در موش محصول دو ژن مختلف (GPT۱ و GPT۲) هستند.
GPT۱ بر روی کروموزوم ۸ و GPT۲ بر روی کروموزوم ۱۶ واقع شدهاند، همچنین فرم سیتوزولیک و میتوکندریایی AST هم توسط دو ژن مختلف کد میشوند. GOT۱ بر روی کروموزوم ۱۰ و GOT۲ بر روی کروموزوم ۱۶ است و احتمالاً تا حدودی نیز از کروموزوم ۱ و ۱۲ کد میشود. اکنون مشخص گردیده که ALT۱ فرم غالب ALT در کبد میباشد. در توافق با یافتههای قبلی، مطالعات جدید نیز نشان میدهند که PPARa بطو خاص بیان ژن GPT۱ را کنترل میکند. تیمار با فنوفیبرات در محیط کشت سلولهای هپاتوسیت انسانی بیان ALT را با افزایش اتصال PPARa به پروموتورهای GPT۱ افزایش میدهد، علاوه بر این حذف محل اتصال PPAR بر روی پروموتور بیان GPT۱ را بر اثر القای فنوفیبرات کاهش میدهد.
در مجموع شواهد متعدد حاکی از نقش PPARa در تنظیم سطح ALT و AST و بهویژه ALT۱ میباشد. به نظر میرسد مکانیسمهای دیگری بیان GPT۲ را تنظیم میکنند. مطالعات اخیر نشان میدهند که بیان ALT و AST ممکن است توسط علامتدهی IRE۱a/c-Jun هم کنترل شود. مشخص شده که به هنگام تیمار با یک مهارکننده (MTP) Microsomal Triglyceride Transfer Protein هم در لیزات و هم محیط سلولهای Huh-۷ مقدار ALT۱ و AST۱ افزایش مییابد و افزودن IRE۱a یا c-Jun مانع این افزایش میشود. از این دادهها درمییابیم که افزایش بیان ژنهای ALT و AST به افزایش سطح سرمی آنها منجر میشود. شاید این مسئله تا حدودی به توضیح تفاوت زیاد در فعالیت آمینوترانسفرازهای سرم در افراد مختلف به هنگام آسیب کبد کمک کند و همچنین توجیهگر تناسب ضعیف سطح سرمی آمینوترانسفرازها با وسعت نکروز کبد و سرانجام بیمار باشد. جالب است بدانیم که برخی عوامل تغذیهای مانند مصرف پروتئین میتوانند بر میزان آمینوترانسفرازها اثر بگذارند. چاقی و استئاتوز در حد جزئی به افزایش ALT۲ در کبد منجر میشوند. با افزایش رشد چاقی در افراد، باید به این مسئله اندیشید که چاقی مقدار ALT سرم را در آسیبهای کبدی افزایش میدهد.
در مجموع گرچه مرگ سلولی و تخریب غشاء سلولی احتمالاً اصلیترین علت افزایش آمینوترانسفرازهای سرم میباشد، اما علل دیگر هم بهوضوح در این افزایش اثرگذار هستند. مکانیسمهای افزایش ALT و AST در افراد بدون علامت بهخوبی بررسی نشده است. ممکن است وزیکولهای خارج سلولی مانند میکرووزیکولها و اگزوزومها و یا ترشح پروتئین در این پدیده مؤثر باشند. علاوه بر این گرچه فرض بر این است که مقدار پایه آمینوترانسفرازهای سرم ناشی از مرگومیر و تولید طبیعی هپاتوسیتها باشد، ولی امکان دارد که مکانیسمهای دیگری نیز در آن مؤثر باشند.
باید در نظر داشت که افزایش فعالیت آمینوترانسفرازهای سرم همیشه نشاندهنده افزایش آزاد شدن یا بیان آنها نیست. ترکیب آنزیمهای سرم با ایمونوگلوبینها یا سایر پروتئینها میتواند بهطور متوسط موجب افزایش آنها شود. این ماکروآنزیمها از آنزیمها در قبال تجزیه محافظت کرده و نیمهعمر آنها را افزایش داده و موجب افزایش سطح سرمی آنها میشوند. در این صورت علیرغم تولید و رهایش طبیعی، مقدار ALT و AST افزایش مییابد. به موارد متعددی از ماکروآنزیمهای آمینوترانسفراز در مقالات اشاره شده است. ماکروآنزیمها در موارد افزایش ALT و AST باید مدنظر باشند، بهویژه اگر فقط یکی از آن دو افزایش یافته باشد. در یک بررسی مشخص شد که حدود ۱۳% موارد افزایش AST بدون افزایش همزمان ALT مربوط به حضور ماکروآنزیم ها بوده است.
آینده بیومارکرهای کبد
در دهه گذشته تمایل زیادی برای گسترش بیومارکرهای جدید برای بررسی آسیبهای کبد مشاهده شده است. سه انگیزه اصلی این تمایل عبارتند از:
- در آزمایش داروهای جدید بر روی جمعیت نیاز به مارکری وجود دارد که سریعاً مسمومیت با دارو را نشان دهد.
- نیاز به بیومارکری که بتواند سرانجام یک آسیب شدید کبدی را پیشبینی کند
- نیاز به داشتن یک بیومارکر غیرتهاجمی که در انتقال مکانیسمهای پاتوفیزیولوژی از جوندگان به انسان مفید باشد
متداولترین مدل مورد استفاده برای دست یافتن به بیومارکرهای جدید برای هر سه هدف مذکور مدل اوردوز استامینوفن (APAP) میباشد. این مدل هم به لحاظ تجربی و هم به لحاظ بالینی مناسب است APAP را در موش میتوان با یک دوز واحد بزرگ ایجاد نمود و دوره شروع بیماری سریع میباشد.
علاوه بر این اوردوز استامینوفن از علل شایع نارسایی حاد کبد در انسان است و لذا امکان تهیه نمونه بالینی از بیماران راحتتر از موارد مسمومیت با سایر داروها میباشد (Lee,۲۰۰۸). به همین دلیل در بیشتر تحقیقات مربوط به بیومارکرهای آسیب کبدی از نمونه ناشی از مسمومیت با استامینوفن در انسان یا موش استفاده میشود. متأسفانه تحقیقات اندکی در این خصوص برای محاسبه ppv و npv طراحی شدهاند، معذلک تقریباً در همه این تحقیقات یک بیومارکر جدید را با ALT و یا AST مقایسه نموده و نشان دادهاند که بیومارکر جدید بهتر از آمینوترانسفرازها در تشخیص آسیب کبد و پیشبینی سرانجام بیماری عمل میکند. گروههای اصلی بیومارکرهای جدید در جدول ۲ آمده است و در ادامه آنها را شرح میدهیم:

بیومارکرهای آسیب میتوکندری
به نظر میرسد که آسیب به میتوکندری و انهدام آن از مکانیسمهای معمول هپاتوتوکسیسیته داروها میباشد و این مکانیسم بهویژه در مسمومیت با استامینوفن اهمیت دارد. بیومارکرهای متعددی مربوط به آسیب میتوکندری شناسایی و پیشنهاد شدهاند. مشخص شده که گلوتامات دهیدروژناز (GLDH) که یک آنزیم میتوکندریال است و نیز DNA مربوط به میتوکندری (mtDNA) پس از مسمومیت با استامینوفن و هپاتیت هیپوکسیک افزایش مییابند و این مارکرها مختص آسیب میتوکندری هستند. تحقیقات جدیدتر نشان میدهند که آسیل کارنیتینها، کاربامیل فسفات سنتتاز-۱ (CPS۱) که یک آنزیم ماتریکس میتوکندری است و اورنیتین کاربامیل ترانسفراز، بیومارکرهای احتمالی اختلال میتوکندری هستند. گرچه همه این بیومارکرها در تحقیقات کاربردی مفید هستند، اما استفاده بالینی از آنها تاکنون محدود بوده است. همچنین گرچه مقدار برخی از آنها در سرم کسانی که بر اثر اوردوز فوت کردهاند بیشتر از افراد زنده بوده است اما حساسیت آنها در پیشبینی سرانجام بیمار کم بوده است. معذلک این بیومارکرها قدم اول در رسیدن به بیومارکرهایی هستند که سرانجام بیمار را بهتر از آزمایشات کنونی پیشبینی میکنند. کما اینکه مقدار ALT سرم هیچ ارتباطی با سرانجام بیمار نشان نمیدهد.
بیومارکرهای مرگ سلولی
دو شکل مرگ سلولی، نکروز انکوتیک و آپوپتوز میباشد که برای هر دوی آنها بیومارکرهایی وجود دارد. در حال حاضر معمولترین بیومارکر سرمی برای مرگ سلولی (K۱۸)Keratin-۱۸ میباشد که شواهدی وجود دارد که نشان میدهد K۱۸ در پیشبینی سرانجام بیمار کارآیی دارد. مشخص شده که مقدار K۱۸ در شروع مسمومیت با استامینوفن میتواند گسترش آسیب کبدی را پیشبینی کند.
قدرت این پیشبینی بهمراتب بهتر از ALT میباشد. علاوه بر این بین K۱۸ و یک بیومارکر مرگ سلولی دیگر بنام (HMGB۱)High- Mobility Group Box ۱ protein و سرانجام وخیم مسمومیت با استامینوفن رابطه قابلتوجه وجود دارد. بالاترین نسبت ppv و npv برای تشخیص زودهنگام آسیب کبد در مسمومیت با استامینوفن مربوط به HMGB۱ بوده که به ترتیب ۹۱% و ۸۷% بوده است. فعالیت آنزیم Caspase هم در جریان خون بهعنوان مارکر مرگ سلولی آپوپتوز قابل اندازهگیری میباشد ولی استفاده بالینی آن ارزیابی نشده است.
بیومارکرهای تخریب DNA
تخریب DNA را میتوان با ژل آگاروز و یا با بررسی نوکلئوزومها توسط ایمونواسی بررسی نمود. اجزای DNA هسته را با روش ایمونواسی در سرم یا پلاسمای فرد مسموم با استامینوفن و در سایر مسمومیتها میتوان اندازهگیری کرد و معمولاً مقدار آنها نسبت به افراد کنترل بالا میباشد. همچنین مقدار آنها در خون کسانی که فوت میکنند بیشتر از افرادی است که زنده میمانند اما حساسیت و ویژگی در مجموع پایین است.
بیومارکرهای اسیدهای هستهای
کشف نسبتاً جدید در مورد شناسایی (miRNA) microRNAs اشتیاق زیادی را برای استفاده از miRNA و سایر اسیدهای هستهای بهعنوان بیومارگر برانگیخته است. مطالعات متعددی حاکی از افزایش miR-۱۲۲، miR-۱۹۲، miR-۱۲۵ و سایر miRNAها در سرم یا پلاسمای انسان یا موش مسموم با استامینوفن بوده است و برخی از این miRNAها در بعضی موارد به نظر میرسد که حساسیت بالایی نسبت به هپاتوکسیسیته دارند. ppv وnpv برای miR-۱۲۲ بعد از مسمومیت با استامینوفن شبیه واریانتهای K۱۸ و به ترتیب ۷۳% و ۸۷% بوده است و افزایش آن نشانگر پیشآگهی ضعیف میباشد. استفاده از miRNA میتواند فراتر از تشخیص آسیب کبد و سرانجام آن برود و میتوان از آن در تشخیص علت اصلی آسیب هم استفاده کرد، بهعنوان مثال استفاده از پروفایلهای miRNA میتواند بین هپاتوتوکسیسیته ناشی از استامینوفن و هپاتیت هیپوکسیک افتراق قائل شود.
سایر بیومارکرها
تغییرات در انواع مختلفی از اجزاء سرم و پلاسما در نتیجه آسیب کبد گزارش شدهاند، بهعنوان مثال argininosuccinate synthetase زودتر از ALT در آسیب کبد افزایش یافته و حساسیت بیشتری هم دارد. برخی اسیدهای صفراوی نیز در آسیب حاد کبد افزایش مییابند. حتی مارکرهایی که برای تشخیص یا پایش بیماریهای دیگری جز آسیب کبدی بکار میروند ممکن است در جریان آسیب کبد در سرم افزایش داشته و در پیشبینی سرانجام بیماری مفید باشند. از مـــــیان این مارکرها میتوان به (KIM-۱) Kidney injury molecule-۱ و تروپونین I اشــــــــاره کرد. آلدولاز B و macrophage colony stimulating factor ۱ دو بیومارکر دیگر پیشنهادی در این رابطه میباشند. همچنین پانلی از بیومارکرها برای افزایش حساسیت و ویژگی پیشنهاد شده است. در نهایت، سیتوکاینها و مارکرهای التهابی متعددی ازجمله IL-۶، IL-۸ و HMGB۱ HB استیله در پروسه آسیب کبدی در سرم افزایش مییابند.
نتیجهگیری
هدف از این مقاله مدح و تعریف از آمینوترانسفرازها و سایر مارکرهای آسیب کبد نیست؛ آنها در آینده هم ابزار مهمی در تشخیص و مطالعه آسیب کبد خواهند بود. هدف، فراهم کردن درک بهتر از آمینوترانسفرازها و بحث درخصوص مارکرهای جدید میباشد که در آینده جایگزین آمینوترانسفرازها شده و یا در کنار آنها مورد استفاده واقع خواهند شد. مشخص شده که بیومارکرهای جدید متعددی هستند که از ALT و AST عملکرد بهتری در تشخیص آسیب کبد و پیشبینی سرانجام آن دارند، اما قبل از اینکه بهطور روتین وارد عرصه بالین شوند باید ppv و npv آنها ارتقاء یابد. این ارتقا میتواند از طریق استفاده از یک پانل بیومارکر و یا کشف بیومارکر جدید باشد. همچنین شواهدی وجود دارد که برخی مارکرها ازجمله GLDH، mtDNA، اجزاء DNA هسته، K۱۸ و HMGB۱ نشانگر مکانیسمهای پاتوفیزیولوژیک خاص هستند و لذا در تحقیقات حیوانی میشود از آنها استفاده نمود. در نهایت مطالعات بیشتری لازم است تا مشخص شود کدامیک از بیومارکرهای جدید در پیشبینی مسمومیت ایدیوسینکراتیک در کار آزماییهای دارویی مفید خواهند بود.
فراپژوهش