مقدمه:
علیرغم پیشرفت پزشکی جدید، باکتریها همچنان یکی از بزرگترین خطرات برای سلامت انسان هستند. از زمان کشف پنیسیلین در ۱۹۲۹ توسط فلمینگ، آنتیبیوتیکهای مشتق شده از میکروبها درمان ضدباکتریایی را کاملاً متحول کردهاند. در واقع پنیسیلین انتخاب درمانی اصلی برای بیماریهای عفونی شد. بهعلاوه، این کشف منجر به یک رشتهی جدید در کشف داروهای ضدباکتریایی از باکتریها و قارچها شد که پزشکی را مسلح به ترکیبات بیشمار مؤثر آنتیبیوتیکی جدید کرد. با این حال، با فرا رسیدن دهه ۱۹۴۰، استفادهی گسترده از پنیسیلین منجر به ظهور سویههای جدید میکروبی شد که قادر بودند دارو را از بین ببرند و تأثیرات آن را خنثی کنند. بهطور مشابه، باکتریها علیه بسیاری از آنتیبیوتیکهای دیگر نیز مقاومت نشان دادند. این گرایش نوظهور، نگرانکننده است و توسط سازمان بهداشت جهانی (WHO) بهعنوان اضطراریترین مسئلهای که علم پزشکی با آن مواجه است در نظر گرفته شده است.
باکتریها قدیمیترین و شایعترین موجودات زنده روی زمین هستند. آنها متنوع و تطبیقپذیر هستند و کومنسال تمام پستانداران میباشند. بسته به تعاملات میزبان، آنها میتوانند برای سلامت میزبان هم حیاتی و هم مضر باشند. آب و هوا، محیط زیست، قومیت، ژنتیک، رژیم غذایی و میزان فعالیت از عواملی است که منجر میشود میکروبیوم دارای تنوع باشد و ممکن است حساسیت میزبان را نسبت به پاتوژنهای فرصتطلب تغییر دهد. در طی تکامل، انسانها یاد گرفتهاند که با میکروبهای متعددی که در همه جای این سیاره موجودند همزیستی کنند. بااینکه میکروبهای خاصی میتوانند همزیست متقابل باشند، بخش قابلتوجهی از آنها پاتوژن هستند و میتوانند منجر به بیماریهای بیشمار عفونی تهدیدکنندهی حیات شوند. این نکته بسیار جالب توجه است که بسیاری از باکتریهایی که میتوانند بیماریهای انسانی ایجاد کنند، در عین حال برای میکروبیوم انسانی ضروری هستند. مصرف دارو درحالیکه درمان بیماریهای خاصی محسوب میشود، میتواند همچنین تعادل جمعیت میکروبی روده را به هم بزند و محرک بسیاری از تأثیرات مخرب ناشی از آن باشد. برخی باکتریها ممکن است با مکانیسم مقاومت در برابر دارو، در جمعیتهای حساس باقی بمانند. مقاومت چند دارویی (MDR)، با عدم حساسیت به حداقل یک ماده در بیش از دو دستهی شناخته شدهی مواد ضد میکروبی تعریف میشود. پاتوژنهایی که بهعنوان مقاوم به طیف داروهای گسترده (XDR) شناخته میشوند تنها به دو دسته یا کمتر از دستههای آنتیبیوتیکها حساس هستند و در نتیجه، یک تهدید جدی برای سلامت بشر بهحساب میآیند.
همزمان با ظهور فزایندهی مقاومت باکتریایی به آنتیبیوتیکها، از آن سو کاهشی در کشف مواد ضدمیکروبی رخ داده است. این مسئله پژوهشگران را به سمت کشف درمانهای جایگزین شامل درمانهای بر پایهی گیاهان سنتی، درمانهای باکتریوفاژی و درمانهای ترکیبی سوق داده است. این مطالعهی مروری مکانیزمهای مقاومت باکتریایی و استراتژیها (هم استراتژیهای مرسوم و هم استراتژیهای جدید) را برای توسعهی درمانهای آنتیبیوتیکی جدید مورد بحث قرار میدهد. در این حین، ما بر نقش محصولات گیاهی طبیعی و عصارهی گیاهان بهخصوص درون ترکیبات سینرژیک، به دلیل دارا بودن پتانسیل توسعهی سریعتر مدلهای درمانی مؤثر برای مبارزه با پاتوژنهای مقاوم به درمانهای آنتیبیوتیکی مرسوم، تأکید میکنیم.
یک تاریخچهی کوتاه از آنتیبیوتیکها
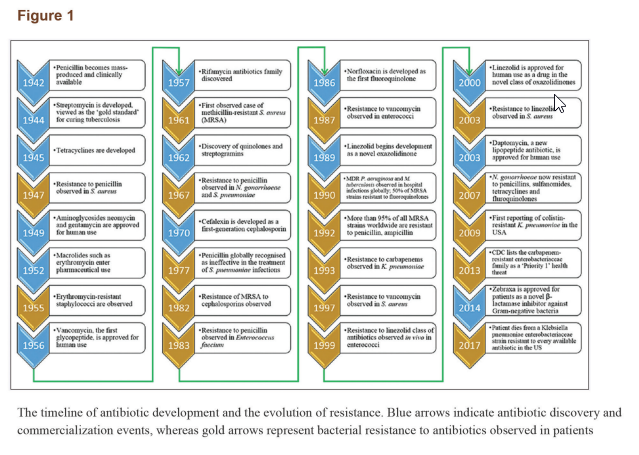
تا اوایل قرن بیستم، درمان عفونتهای پاتوژنی متکی به داروهای سنتی (بهخصوص مواد گیاهی) بود. کشف پنیسیلین، روش درمان بیماریهای عفونی را به کل دگرگون کرد. این کشف فوقالعاده، ناشی از مشاهدهی اتفاقی این پدیده بود که رشد استافیلوکوک ارئوس در ظرف کشت توسط یک قارچ آبی رنگ (یک قارچ از جنس پنیسیلیوم) محدود شده است. این پدیده نشان میداد برخی میکروارگانیسمها قادرند موادی تولید کنند که رشد دیگرگونههای میکروبی را محدود کند. کشف پنیسیلین آغاز یک دورهی جدید در روشهای درمانی برای عفونتهای باکتریایی بود. از آن زمان تا آخرین دورهی قرن اخیر، شاهد افزایشی بسیار سریع در تعداد آنتیبیوتیکهای کشفشده بودیم. در طی دههها پس از کشف پنیسیلین و سولفونامیدها، مواد ضدمیکروبی متعدد دیگری با خصیصههای مختلف به جامعهی پزشکی معرفی شدهاند. در واقع، بیست دستهی جدید از آنتیبیوتیکها شامل بتالاکتامها، آمینوگلیکوزیدها، تتراسایکلین، ماکرولیدها، فلوروکوینولونها و سفالوسپورینها برای استفادهی بالینی در طی دو دهه پس از معرفی پنیسیلین گسترش یافتند. بتالاکتامهای بهبودیافته و مهارکنندههای بتالاکتاماز درمان و کنترل مؤثری برای کل خانوادهی انتروباکتریاسه فراهم کردند. تا ۱۹۸۹ دستهی تازهای از آنتیبیوتیکها معرفی نشد. هر دسته از آنتیبیوتیکها یک چهارچوب مرکزی یکسان دارند. متعاقباً بسیاری آنتیبیوتیکها از طریق دستکاری سنتتیک این چهارچوبها ایجاد شدهاند. با کشفیات انجامشده از اواسط دهه ۱۹۳۰ تا اوایل دهه ۱۹۶۰، چهارچوب شیمیایی بسیاری از آنتیبیوتیکها که امروزه مورد استفاده قرار میگیرند مشخص شد. آنتیبیوتیکهای موجود متعاقباً بهبود یافتند تا سمیت آنها کم شود، طیف فعالیتشان افزایش یابد و همچنین از نظر میزان کاراییشان نسبت به دیگر آنتیبیوتیکها بررسی شدند. چهارچوبهای سفالوسپورینها، پنیسیلینها، کوینولونها و ماکرولیدها تقریباً شامل سهچهارم آنتیبیوتیکهای جدید کشف شده بین ۱۹۸۱ تا ۲۰۰۵ میشود. عصر طلایی کشف آنتیبیوتیک در اوایل دهه ۱۹۶۰ به پایان رسید و ایجاد مقاومت باکتریایی از آن زمان جایگزین کشف دارو شده است. یک جدول زمانی از بکارگیری آنتیبیوتیکها و افزایش مقاومت دارویی در شکل ۱ نشان داده شده است.
استفادهی غلط از آنتیبیوتیکها منجر به ایجاد گستردهی مقاومت توسط بسیاری از گونههای باکتریایی شده است، در نتیجه دو رویداد عمده بهموازات هم در طی قرن گذشته رخ دادهاند؛ کشف مواد ضدمیکروبی بهطور پیوسته کاهش یافته و به تعدادی ناچیز از آنتیبیوتیکهای سنتتیک یا کشفشده در دههی گذشته انجامیده است. بهطور همزمان، مقاومت آنتیبیوتیکی بهسرعت افزایش یافته و ارگانیزمهای با مقاومت چندگانه پدید آورده که کنترل آنها با درمانهای آنتیبیوتیکی فعلی دشوار است. گسترش روشهای درمانی جایگزین، اهمیتی حیاتی دارد و از نظر WHO شاید بزرگترین چالش پیش روی علم پزشکی باشد.
عملکرد آنتیبیوتیک
آنتیبیوتیکها برای کشتن باکتریها یا محدود کردن رشد آنها از راههای مختلفی عمل میکنند (شکل۲a )؛ بسته به دستهی آنتیبیوتیکها، آنها میتوانند سنتز پروتئینها و متابولیتها را متوقف کنند، تقسیم دوتایی را مختل کنند یا پیوستگی دیواره سلولی را آسیب بزنند. باکتریها میتوانند بهطور ذاتی توسط فشار انتخابی، مقاومت ایجاد یا ابزار مقاومت را از میکروبهای همسایه بگیرند. باکتریها اجزای متحرک مقاومت (MREs) را، شامل ترانسپوزونها، پلاسمیدها و اینتگرونها اعزام میکنند که مواد ژنتیکی لازم برای ایجاد مقاومت را با خود حمل میکنند، اما شامل ژنهای حیاتی برای عملکرد سلول نیستند. MREها میتوانند هم به شکل مستقیم بین سلولهای مجاور (کنژوگاسیون) و هم غیرمستقیم با نجات اجزای سالم باقیمانده از دیگر باکتریها (ترانسفورماسیون) در بین راستههای مختلف باکتریها منتقل شوند. فشار انتخابی بر روی آن دسته از MREها که برای بقای باکتری ضرورت دارند موجب حفظ مکانیزمهای مقاومت دارویی در نسل بعدی باکتریها میشود.
سیر تکامل مقاومت باکتریایی
در دوران طلایی آنتیبیوتیکها، صدها مادهی ضد میکروبی برای درمان بیماریهای عفونی توسعه یافتند. این فوران داروهای جدید مورد تأیید جهت مصرف انسانی، در کنار واکسیناسیون، به شیوع فراگیر بسیاری از بیماریهای عفونی پایان داد. با تجویز چهار روزهی پنیسیلین از نیمی از مرگهای پس از تولد ناشی شده از استرپتوکوکوس پیوژنز جلوگیری شد. میزان مرگومیر در اثر عفونت با استافیلوکوک ارئوس بهطور تخمینی تا ۸۰ درصد کاهش داشت و در نتیجه از اهمیت این عفونت کاسته شد. بیماریهای دیگری همچون زردزخم یا جذام در کشورهای توسعهیافته ریشهکن شدند یا بسیار بهندرت رخ میدهند، اما امروزه ازآنجاکه بسیاری از سویههای باکتریایی، مکانیسمهای مقاومت را کسب کردهاند، تأثیر بسیاری از این مواد ضدباکتریایی اولیه محدود شده است. عوامل متعددی در افزایش مقاومت آنتیبیوتیکی سویههای باکتریایی دخیلند. استفاده از آنتیبیوتیکها در بسیاری از صنایع افزایش یافته است. درنتیجهی تقاضای بالا، آنتیبیوتیکها با کارایی بهبودیافته و قیمت کاهشیافته تولید شدهاند. در نتیجه، این داروها به میزان زیاد در محیط آزاد شده و منجر به انتخاب سویههای مقاوم میشوند. پاتوژنهای متعددی شامل استرپتوکوک پنومونیه، عامل بیماریهای متعددی مانند عفونت گوش میانی، پنومونی و مننژیت مقاومت چنددارویی کسب کردهاند. حدود دوسوم تمام عفونتهای گوش، عامل باکتریایی دارند و حدوداً ۸۵% موارد میتوانند بدون درمان آنتیبیوتیکی درمان شوند. با این حال، هنوز در آمریکا تقریباً برای تمام کودکانی که دچار عفونت گوش هستند آنتیبیوتیک تجویز میشود که منجر به ایجاد مقاومت میگردد. به دلیل استفادهی غلط و درنتیجه ایجاد مقاومت به پنیسیلین، دیگر نمیتوان برای درمان مننژیت ناشی از استرپتوکوک پنومونیه تنها به این دارو اتکا کرد. این مسئله به همراه استفادهی بیشازحد یا غلط آنتیبیوتیکها، فشارهای انتخابی متعددی را بر روی پاتوژنهای میکروبی ایجاد کرده که منجر به افزایش مقاومت گشته است.
سویههای میکروبی دارای مقاومت چندگانه:
شمار میکروبهای MDR (که عموماً به نام سوپرباگ superbug شناخته میشوند) به دلیل استفادهی غلط گسترده از آنتیبیوتیکها با سرعت قابلتوجهی در حال افزایش است. به دلیل رخ دادن جهشهای متعدد در میکروبهای MDR، شدت بیماری و همچنین میزان مرگومیر در بیماریهای ناشی شده از این میکروبها افزایش مییابد، بنابراین راههای درمانی موجود برای این بیماریها بهطور مشهود در حال کاهش هستند. ویرولانس و همچنین قابلیت انتقال برخی سویههای میکروبهای MDR افزایش یافته است. سل در حال حاضر حدود یکسوم از جمعیت انسانی را آلوده میکند. بااینکه استرپتومایسین و ایزونیازید قبلاً درمان مؤثری برای این بیماری بودهاند، گسترش مقاومت سریع بوده و امروزه شاهد سویههای XDR و حتی فرمهای کاملاً مقاوم به دارو (TDR) از این پاتوژن هستیم. استافیلوکوک ارئوس نیز در فاصلهی نسبتاً کمی پس از کشف پنیسیلین به آن مقاوم شد. متیسیلین (اولین آنتیبیوتیک طراحی شده بر ضد مقاومت دارویی) در ۱۹۶۰ برای مقابله با پنیسیلیناز معرفی شد و استافیلوکوک ارئوس مقاوم به متیسیلین (MRSA) کمی پس از آن ظهور کرد. استقرار سویههای MRSA در جامعه احتمالاً به دلیل استفادهی بیش از حد از مواد آنتیباکتریال در نظافت خانه و بیمارستان برای به دست آوردن محیط بسیار تمیز است. تریکلوزان یک زیستکش غیراختصاصی است که در کلینیکها و بیمارستانها برای دههها استفاده شده است. استفادهی بیش از حد از تریکلوزان در صابونها، مواد ضدعفونیکننده و شویندههای لباس منجر به ایجاد سویههای پاتوژن مقاوم به تریکلوزان، شامل MRSA شده است. به همین صورت استفادهی نابجا از مواد ضدمیکروبی متعدد دیگر منجر به تشکیل بسیاری از پاتوژنهای MDR گشته است و این مسئله پیش از آنکه کنترل مقاومت آنتیبیوتیکی دشوارتر شود نیازمند توجه فوری است.
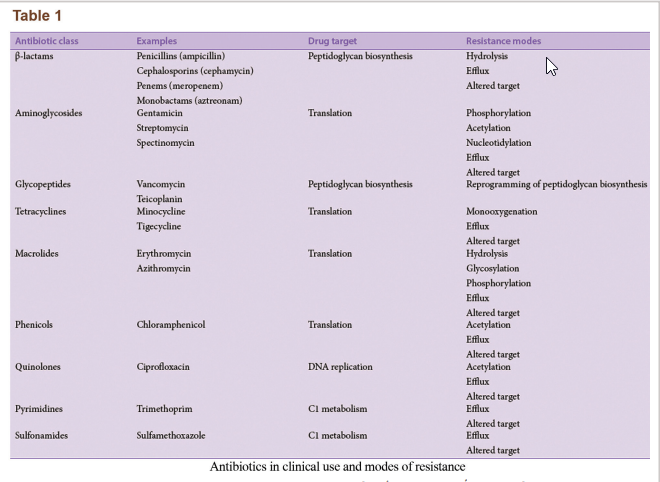
مکانیزمهای مقاومت
باکتریها روشهای متعددی برای ایجاد مقاومت آنتیبیوتیکی دارند (شکل ۲b). عدم حساسیت به دارو در سویههای باکتریایی مقاوم به آنتیبیوتیک عمدتاً از ژنهای مقاومت و تأثیرات آنها ناشی میشود. ژنهای مقاومت از طریق پلاسمیدها منتقل میشوند که منجر به نجات باکتریها در محیط میگردد. ژنهای مقاومت میتوانند کدکنندهی ایفلاکس پمپها که آنتیبیوتیک را از سلول بیرون میراند یا کدکنندهی ژنهایی باشند که آنزیمهای تخریب یا غیرفعالکنندهی آنتیبیوتیک را القا میکنند. این خصیصهها میتواند به نسل بعدی منتقل شود، از دیگر پاتوژنها انتقال یابد یا در طی جهشهای اتفاقی در DNA باکتری رخ دهد، بهعلاوه، میکروبها از طریق مکانیزمهای متعدد دیگری نیز میتوانند از حملهی آنتیبیوتیکی پیشگیری کنند. یک خلاصه از برخی دستههای داروهای آنتیبیوتیک اصلی و مکانیزمهای مقاومت باکتریایی در جدول ۱ نمایش داده شده است. هر نوع یا دسته از آنتیبیوتیکها میتوانند مواجه با بیش از یک مکانیزم یگانه مقاومت بشوند و در نتیجه میتوانند به MDR، XDR یا TDR تبدیل شوند.
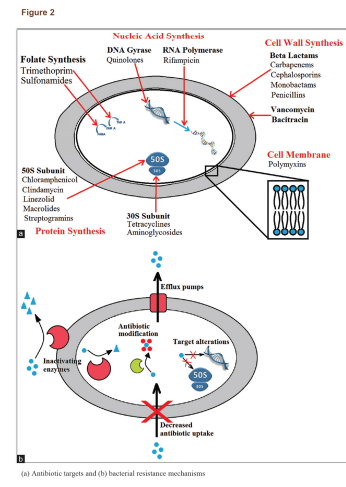
مکانیزمهای مقاومت باکتریایی ممکن است نفوذپذیری غشاء باکتری به آنتیبیوتیک را مهار کنند، آنزیمهایی تولید کنند که آنتیبیوتیکها را خنثی کند یا هدف آنتیبیوتیک را تغییر دهد تا اتصال صورت نگیرد. این مکانیزمها ممکن است اختصاصی یک آنتیبیوتیک هدف باشند یا فعالیت با طیف گسترده داشته باشند. اغلب، آنتیبیوتیکها در برابر باکتریهای MDR باید تغییر داده شوند یا بهصورت ترکیبی استفاده شوند تا از این مکانیزمها پیشگیری شود؛ بهعنوان مثال بتالاکتامها (برای مثال پنیسیلین، آمپیسیلین و کاربنیسیلین) اغلب در ترکیب با مهارکنندههای آنزیم بتالاکتاماز استفاده میشوند. بتالاکتامهای تغییریافته (برای مثال متیسیلین، اگزاسیلین) نسبت به تخریب توسط بتالاکتامازهای با طیف محدود ایمن هستند. استافیلوکوکهای مقاوم به متیسیلین برای مقاومت نسبت به بتالاکتامهای تغییر یافته از بتالاکتامازهای وسیعالطیف (ESBL) استفاده میکنند یا پروتئین متصل شونده به پنیسیلین(PBP) خود را دچار جهش میکنند تا باکتری نتواند با داروهای مشابه پنیسیلین اتصال مؤثری برقرار کند.
مقاومت باکتریایی و محیط زیست
سیستم گوارشی انسانها و حیوانات یک مخزن ایدهآل برای گسترش MDR است. بیمارانی که در بیمارستانها آنتیبیوتیک دریافت کردهاند یا حیوانات اهلی که به آنها آنتیبیوتیک خورانده شده بالاترین عوامل خطر برای گسترش مقاومت هستند. همچنین آنتیبیوتیکها در دوزهای کمتر از دوز درمانی برای افزایش رشد گاوها، خوکها، ماکیان و ماهیها استفاده میشوند. انتشار آنتیبیوتیکها مانند بتالاکتامها، کلستین، ماکرولیدها، سولفونامیدها، تریمتوپریم، فلوروکوینولونها و تتراسایکلینها در محیط زیست، شیوع MREها را بیشتر میکند. آنتیبیوتیکها و متابولیتهای آنها بسته به حلالیت و قطبیتشان ممکن است توسط شویندهها یا آنزیمها تخریب شوند، در گلولای فاضلاب شهری تجمع کنند یا وارد سیستم رودخانهها شوند. داروهای موجود در گلولای میتوانند هنگامی که این گلولای بهعنوان کود استفاده میشوند وارد سیستم کشاورزی شوند، همچنین فاضلاب و آبهای سطحی زمین که آلوده به داروها شدهاند از طریق سیستم آبیاری وارد اکوسیستم میشوند. آنتیبیوتیکهایی که به حیوانات خورانده میشود میتوانند هنگامی که بهعنوان کود به درون محصولات کشاورزی، خاک و بقایای آنها وارد میشوند، دوباره مستقیماً وارد محیط شوند. داروهای دامپزشکی و متابولیتهای آنها میتوانند بعد از اینکه به همراه غذا به حوضچههای پرورش ماهی اضافه شدند، مستقیماً به منابع آبی وارد شوند.
مشخص شده که طیف وسیعی از آنتیبیوتیکها برای ماهها و حتی سالها در محیط باقی میمانند. در سال ۲۰۱۳ مشخص شد که آنتیبیوتیک ماکرولیدی تیلوزین منابع آبی آمریکا را آلوده میکند. آنتیبیوتیکها همچنین میتوانند در طی پروسهی ساخت وارد محیط زیست شوند. این مسئله مخصوصاً برای کشورهایی مانند هند و چین که در آنجا آنتیبیوتیکها در مقیاسهای وسیع برای حیوانات ساخته میشوند و مقرراتشان نیز کمتر سختگیرانه است، مشکلی جدی محسوب میشود. باکتریهای MDR، MREهای متحرک یا بقایای آنتیبیوتیکها میتوانند از طریق آلوده ساختن غذا به انسان بازگردند. آنها ممکن است بدون اینکه آسیبی برسانند از روده عبور کنند و به فاضلاب بازگردند، اما میکروفلور طبیعی روده فرصت مناسبی برای انتقال افقی ژن میدهد و در نتیجه مقاومت میتواند به مقاومت باکتریایی چندگانه گسترش یابد.
تأثیر جهانی مقاومت آنتیبیوتیکی بر روی سلامت انسان
یک ارتباط آشکار بین افزایش مقاومت ضدمیکروبی و افزایش همزمان شدت بیماری، میزان مرگومیر و هزینههای مربوط به درمان بیماری وجود دارد. برخی سویههای عمدهی باکتریهای مهم بالینی، بیماریهایی که ایجاد میکنند و مقاومت آنها به داروهای آنتیبیوتیک در جدول ۲ خلاصه شده است. افزایش در شدت و مرگومیر ناشی از درمانهای غیرمؤثر یا دیرهنگام است. این نکته برای بیماریهایی که آنتیبیوتیکهای درمانی جایگزین آنها گران هستند و بهراحتی در دسترس نمیباشند، مهم است. یکی دیگر از عواقب مهم مقاومت آنتیبیوتیکی، افزایش بروز بیماری است. این مسئله بهخصوص در مورد باکتریهای MDR صادق و خطرناک است. انتقال سویههای MDR بهخصوص در بین افراد آسیبپذیر (افراد کم سن، مسن یا دارای مشکل ایمنی) میتواند کشنده باشد. بهعلاوه، مقاومت آنتیبیوتیکی منجر به افزایش مشهود هزینههای درمانی بیماریهای عفونی شده است، بهعنوان مثال به استناد گزارشی در سال ۲۰۰۹ از مرکز پیشگیری و کنترل بیماریها (CDC) هزینهی بستری کردن یک بیمار XDR-TB در امریکا تقریباً ۴۸۳٫۰۰۰ دلار است که دو برابر هزینهی درمان یک بیمار MDR-TB میباشد. اخیراً کنگرهی امریکا یک بودجهی ۴۶۳ میلیون دلاری جهت تحقیقات در زمینهی مقاومت آنتیبیوتیکی اختصاص داده است.
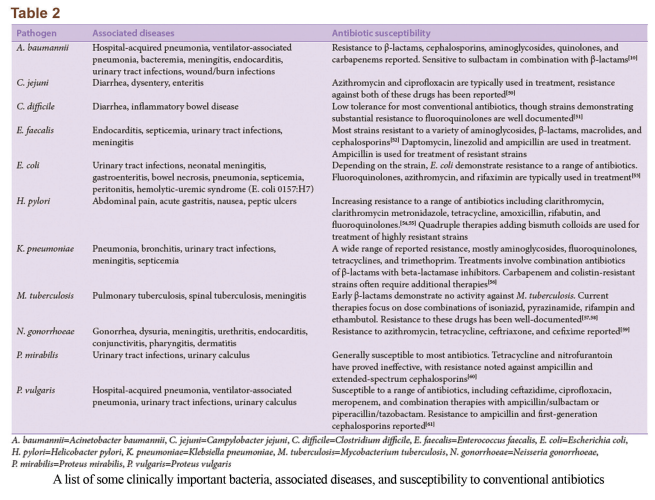
مقاومت دارویی در بیمارستانهای اروپا توسط مرکز کنترل بیماری اروپا و آژانس پزشکی اروپا بررسی میشود. اروپا اکنون در سال با حداقل ۴۰۰٫۰۰۰ مورد بیماری و ۲۵٫۰۰۰ مورد مرگومیر بیماران بستری در اثر باکتریهای MDR مواجه است. تعداد روزهای بستری شدن افزوده شده، ۲/۵ میلیون روز در سال تخمین زده میشود و از ۲۰۰۷ به این سو بیش از ۱/۵ میلیارد یورو در سال هزینه صرف این مسئله شده است. در اروپا موج مقاومت ناشی از ESBLها، اغلب سفالوسپورینهای نسل سوم (سفوتاکسیم، سفتازیادیم و سفتریاکسون) را برای درمان عفونتهای بسیاری از باکتریهای گرم مثبت و گرم منفی بیاثر کرده است.
انتروکوکاسیهی مقاوم به ونکومایسین (VRE) به دلیل مقاومتشان به طیف گستردهای از مواد ضدمیکروبی، یکی از عوامل بسیار مشکلساز در عفونت مجاری ادراری (UTI)، باکتریمی، مننژیت، عفونتهای حفره شکمی و جنینی در اروپا و امریکا میباشند. این مقاومتها که در ابتدا با شیوع عفونتهای انتروکوکوس فاسئوم و انتروکوکوس فکالیس مقاوم به ونکومایسین ظاهر شد ناشی از ژنهای vanA، vanB و vanC منتقله از پلاسمید هستند. انتروکوکوس فکالیس، انتروکوکسی غالبی است که به ونکومایسین مقاومت نشان داده است و عامل ۹۰% از عفونتهای بیمارستانی در بیماران در امریکا میباشد. لینزولید در حال حاضر آخرین آنتیبیوتیک موجود برای درمان عفونتهای VRE میباشد. باید توجه کرد که ایزولههای کلینیکی VRE مقاوم به لینزولید شناسایی شدهاند و نیاز مبرمی به راههای درمانی تازهتر وجود دارد.
MRSA مقاوم به بتالاکتامها، سفالوسپورینها، کارباپنمها و آمینوگلیکوزیدها میباشد. مقاومت به بتالاکتامها درنتیجهی حضور پلاسمیدهای حاوی ژنهای مقاومت mecA و mecB ایجاد میشوند. سهم استافیلوکوک ارئوس در عفونتهای بیمارستانی که بهعنوان MRSA شناسایی شدهاند بین ۱۵ تا ۷۵ درصد در گزارشها از بیمارستانهای مختلف متغیر است. بهطورکلی، وقوع MRSA کشت داده شده از بیماران در امریکا از ۳% برای عفونتهای استافیلوکوکوس در سال ۱۹۸۰ تا بیش از ۶۰% در پایان هزاره دوم افزایش یافت. کمتر از ۲۰% از MRSA در امریکا حساس به فلوروکوینولونهای تجاری هستند. به گزارش CDC مقاومت نسبت به سیپروفلوکسازین در MRSA در ابتدای تأیید شدن آن جهت مصرف بالینی ۵% بود که در طی یک سال به بیش از ۸۰% رسید. با جدا شدن سویههای MRSA با حساسیت جزئی به ونکومایسین از نمونههای آزمایشگاهی، مشکل جدیتر هم میشود. همچنین برخی مطالعات، میزان بالایی از مقاومت به ونکومایسین را در انتروکوکوس فکالیس جداشده از جمعیت بیماران نشان میدهد.
یک سویه باکتریایی دیگر که تهدیدی برای سلامت بشر محسوب میشود کلبسیلا پنومونیه است. پاتوژن فرصتطلب گرم منفی که باعث عفونتهای بیمارستانی و عفونتهای اکتسابی از جامعه شامل سپتیسمی، باکتریمی، UTI، پنومونی، عفونت زخم و اسپوندیلیت آنکیلوزان میشود. بتالاکتامازهای کدشده توسط AmpC و ژنهای مرتبط، حساسیت باکتری را به طیف گستردهای از داروهای بتالاکتام مانند سفالوسپورینها کاهش میدهند. در ادامه آنزیمهای کارباپنم- هیدرولیزین بتالاکتاماز دارای قدرت انتقال شناسایی شده و بهعنوان کلبسیلا پنومونیه کارباپنماز (KPC) ۱، ۲ و ۳ نامگذاری شدند. نتیجه درمان برای بیماران آلوده به سویههای KPC با مقاومت بالا مطلوب نبوده و عموماً با مرگومیر همراه است، بهخصوص برای بیمارانی که آلوده به سویههای با ویرولانس بالا شده و دچار عفونتهای سخت میشوند. اخیراً یک مجموعه ژنهای مقاومت از ایزولههای کلینیکی جداشده از آندمی کلبسیلا پنومونیه XDR در چین شناسایی شده که منجر به مقاومت به بتالاکتامها، کوینولونها، آمینوگلیکوزیدها، کلرامفنیکل و فسفومایسین یا مقاومت به اشکال مختلف مهارکنندهی بتالاکتام میشوند. کلیستین در حال حاضر آخرین راه درمان بیماران آلوده به کلبسیلا پنومونیه مقاوم است. با این حال، ژن mcr-۱ با منشأ پلاسمید، ایجاد مقاومت به این آنتیبیوتیک میکند و خاصیت متحرک بودن پلاسمید منجر به انتقال بینگونهای این ژن مقاومت در بین باکتریهای گرم منفی میشود. این ارتباط مشکلساز بین مقاومت کلی/ اختصاصی، قابلیت انتقال ژنهای مقاومت با منشأ پلاسمید و ویرولانس بالای کلبسیلا پنومونیه احتمالاً عواقبی جدی و درازمدت بر روی سلامت جهانی بشر خواهد داشت، بهعلاوه، این مسئله بر نیاز به تحقیق برای کشف و طراحی مواد شیمیایی درمانی جدید یا راههای تلفیقی درمان ضدمیکروبی تأکید میکند.
کشف آنتیبیوتیکهای جدید: گرایشات اخیر
چنانچه بحث شد، کشف آنتیبیوتیکهای تازه با مکانیزمهای عمل جدید در اواخر دهه ۱۹۶۰ بهشدت کاهش یافت. آخرین دستهی آنتیبیوتیک که پیش از هزارهی جدید کشف شد در ۱۹۶۸ بود و اغلب آنتیبیوتیکهای بعدی، نسخههای بهبودیافته از دستههای آنتیبیوتیکی پیشتر کشفشده بودند. علیرغم تقاضای موجود برای داروهای ضدمیکروبی جدید، گسترش مواد ضدباکتریایی تازه بهطور مشهودی در دهههای اخیر کاهش یافته است. هزینهی تحقیقات و گسترش مواد ضدمیکروبی به مرحلهای رسیده که دنبال کردن توسعهی داروهای جدید بازده مالی کمی برای شرکتهای داروسازی دارد. این مسئله با توجه به بازهی هشت سالهی لازم برای مواد جدید تا از فاز یک آزمایش کلینیکی به محصول نهایی برسند، تشدید شده است. شمار مواد ضدباکتری تأییدشده در طی دورهی ۲۰ ساله از ۱۹۸۳ تا ۱۹۹۲ کاهش یافته است و بین سالهای ۱۹۹۲ تا ۲۰۱۷ حتی کمتر هم شده است (جدول۳).
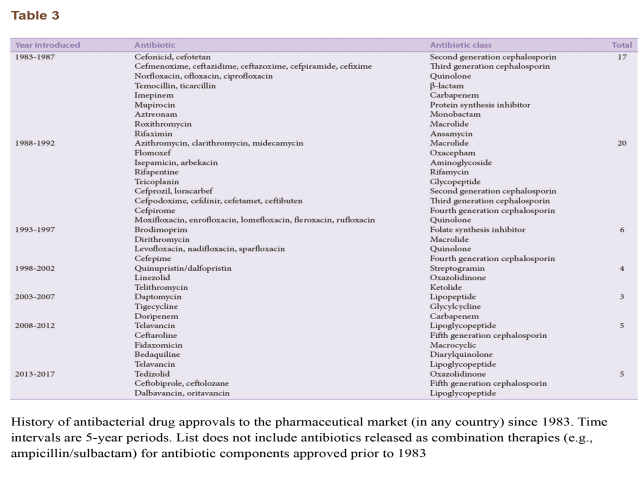
داروهای در حال توسعه و مرحله آزمایش کلینیکی
در حال حاضر تعداد مواد ضدمیکروبی که برای کنترل سیر تکامل باکتریهای MDR در مرحلهی پژوهش و توسعه هستند، کافی نیست. تمام داروهای در حال توسعه باید تحت آزمایشات انسانی گسترده قرار گیرند و هیچ موفقیتی تا زمانی که ماده برای استفادهی انسانی تأیید نشده، منتشر نمیشود. مرحله سوم از مراحل تأیید آزمایشی، تأثیرگذاری دارو را برای استفادهی کلینیکی ارزیابی میکند، درحالیکه کارایی و ایمنی آن از مرحلهی دو نیز دوباره ارزیابی میشود. معمولاً بسیاری از مواد ضدمیکروبی در فاز ۳ رد میشوند. در سال ۲۰۱۰ مرکز مطالعات پزشکی تخمین زده که ۵۰% داروها در فاز ۳ ناموفق بودهاند. فرمولاسیون آنتیبیوتیکهایی که در حال حاضر در مرحله ۳ هستند در جدول ۴ نشان داده شده است.
رسیدن به مرحلهی استفاده برای ضدمیکروبهای تازه ممکن است تا بیش از یک دهه بعد از کشفشان طول بکشد و تنها یکی از هر پنج دارو به اولین مرحله آزمایش انسانی میرسد، بهعلاوه، اغلب این داروهای تأییدشده دارای هشدارهای مصرف متعدد یا محدودیت مصرف هستند؛ بهعنوان مثال سفتولوزان توزیع شده به همراه تازوباکتام (با نام تجاری زرباکسا) در ۲۰۱۴ برای استفادهی انسانی تأیید شد. این دارو فعالیت خاصی علیه سودوموناس آئروجینوزا در بیماران دچار پنومونی اکتسابی از بیمارستان و مرتبط با تهویه نشان میدهد. نظارت پس از فروش رزباکسا هیچ فعالیتی علیه پاتوژنهای غیرهوازی نشان نداد و فعالیت محدودی بهعنوان یک مادهی ضدمیکروبی گرم مثبتها نشان داد. تنها فعالیت محدودی با این فرمولاسیون علیه جمعیت گونههای پاتوژن استافیلوکوکوس و کلستریدیوم دیفیسیل در بیماران مشاهده شد. ترکیب سفتازیدیم با مهارکنندهی بتالاکتاماز جدید، اَویباکتام (با نام تجاری آویکاز فروخته میشود) بعدتر در فوریه ۲۰۱۵ تأیید شد. این دارو در ترکیب با اَویباکتام توزیع میشود تا یک تأثیر مضاعف در بیماران آلوده با باکتریهای گرم منفی ایجاد کند. بیماریهایی که عموماً توسط اَویکاز درمان میشوند شامل پیلونفریت و UTI است. برخلاف زرباکسا، اَویکاز در برابر طیف وسیعی از انتروباکتریاسه فعال است اما همچنان در معرض خطر متالوبتالاکتامازها (دسته B بتالاکتامازها) میباشد. این دارو بر روی هموفیلوس موراکسلا، گونههای نایسریا و گونههای اسینتوباکتر بیاثر است. آنتیبیوتیکهای جدید اغلب در یک گسترهی محدود فعال هستند، گران میباشند و ممکن است در برابر سویههای خاصی در طی زمان بیاثر شوند. در واقع، مواردی از مقاومت به آویکاز هماکنون گزارش شده است.

جایگزینها: منابع جدید آنتیبیوتیک درمانی
انجام واکسیناسیون همراه با آنتیبیوتیکها
آنتیبیوتیکها بهتنهایی یک راهحل پایدار برای درمان عفونتهای باکتریایی نیستند. جایگزینهایی موجودند که در زمانی که آنتیبیوتیکها مؤثر نیستند فعالیت ضدمیکروبی مؤثری از خود نشان میدهند، یا فعالیت آنتیبیوتیک را درون بدن موجود زنده بهبود میبخشند. واکسنها یک راهحل پیشگیرانه برای درمان ارائه میدهند؛ آنها میتوانند ایمنی مادامالعمر ایجاد کنند یا دوز روزانهی موردنیاز برخی از داروها را کم کنند. با این حال مزیت استفاده از آنتیبیوتیکها این است که آنها فعالیتی با طیف گسترده دارند که موجب میشود هنگامی که عامل عفونت ناشناخته است، برای درمان مفید باشند. آنتیبیوتیکها همچنان نقش حیاتی خود را در درمان عفونتها برای بیماران مبتلابه سرطان و عفونتهای مرتبط به جراحی ایفا میکنند. از این منظر، واکسنها و آنتیبیوتیکها به نظر میرسد که بجای همافزایی، یک نقش مکمل یکدیگر را دارند و دشوار است که سودمندی آنها برای سلامت انسان با هم مقایسه شود. بهعنوان مثال، ایمنی عمومی زمانی میآید که بخش قابلتوجهی از جمعیت نسبت به پاتوژن ایمن شده باشند. این مسئله تعداد بیماران نیازمند به آنتیبیوتیک را کم میکند. بهعنوان مثال، یک واکسن کونژوگه پنوموکوکی میتواند استفاده از ماکرولیدها را در بیمارستان بهعنوان خط اولیه و ثانویهی درمان کاهش دهد و همچنین وقوع بیماری استرپتوکوک پنومونیایی مهاجم را هم در کودکان و هم در بزرگسالان متوقف کند. با این حال، کلونهای MDR ظهور یافتهاند که موفقیت واکسیناسیون را تهدید میکنند. این مسئله در کودکان بستری مشاهده شده است.
باکتریوفاژ درمانی
باکتریوفاژها یکی دیگر از جایگزینها برای درمان باکتریهای مقاوم به آنتیبیوتیک هستند. آلوده کردن و کشتن گونههای شیگلا با باکتریوفاژ اولین بار بسیار پیش از اینکه فلمینگ شاهد تأثیرات پنیسیلین باشد، مشاهده شد. مطالعات فاژ درمانی انسانی نشان داده که باکتریوفاژها در درمان بیماران برای شمار متعددی از باکتریهای مهم پزشکی شامل گونههای استافیلوکوکوس، کلبسیلا و سودوموناس مفید هستند و این درمانها در حال حاضر بهطور مؤثری در برخی کشورهای شرق اروپا استفاده میشوند. خصیصههای باکتریوفاژ به نظر میرسد که به استفادهی کلینیکی آنها کمک میکند (امنیت، نیاز به دوز پایین و غیره)، با این حال استفادهی آنها در پزشکی غربی هنوز نیازمند تأیید گسترده است. بسیاری از کارهای اولیه که روی باکتریوفاژهای دارویی- درمانی شده است مطابقت کامل با پروتکل آزمایش داروهای مدرن ندارد، بهعلاوه اکثریـــت تحقیــقات پیگیری (follow-up) در اروپای شرقی انجام شده و هنوز به انگلیسی ترجمه نشده است. علیرغم این مسئله، پزشکی غربی میتواند درمان باکتریوفاژی را بهعنوان یک جایگزین مناسب برای آنتیبیوتیکها در آیندهی نزدیک در نظر بگیرد. مطالعات اخیر، درمانهای باکتریوفاژی را بهعنوان روشهایی موفق و مقرون به صرفه برای درمان عفونتهای باکتریایی مقاوم به آنتیبیوتیک شامل MRSA و سودوموناس آئروجینوزا شناسایی کرده است. این روش درمانی برای برخی باکتریهای پاتوژن نویدبخش است، اما تحقیقات بسیار بیشتری باید در این زمینه صورت گیرد.
داروهای سنتی و درمانهای آنتیبیوتیکی مشتق از گیاهان
در طب سنتی برای قرنهای متمادی از گیاهان دارویی جهت درمان عفونتهای باکتریایی استفاده شده است. حدوداً ۸۰% کشورهای در حال توسعه از داروهای سنتی مشتق شده از گیاهان دارویی بهعنوان روش اولیه مراقبتهای بهداشتی استفاده میکنند. طبق یک نظرسنجی گزارش شده در کنفرانس تجارت و توسعه سازمان ملل، بیش از ۳۳% کل داروهای تولیدشده درکشورهای صنعتی، مشتقات گیاهی هستند و WHO نامهای بیش از ۲۰٫۰۰۰ گونهی گیاهان دارویی را با تنوع کارکردهای احتمالیشان ثبت کرده است. گیاهان دارویی در مقایسه با مشابهان سنتتیک خود اغلب ارزانتر، از نظر عوارض جانبی بیخطرتر و همچنین در دسترستر هستند، بهعلاوه آنها در ترکیباتی که فعالیت ضدمیکروبی دارند بهوفور یافت میشوند. این مواد زیست-فعال (phytochemicals) شامل تانینها، آلکالوئیدها، کربوهیدراتها و گلیکوزیدها، ترپنوئیدها، استروئیدها، فلاوونوئیدها و کومارینها میباشند. این ترکیبات دارای ارزش پزشکی ویژهای هستند چرا که بهطورکلی علیه فعالیت زیستی آنها مقاومت ایجاد نمیشود. در زمانی که این مقالهی مروری نوشته شده، هیچ گزارشی مبنی بر اینکه شاهد بروز مقاومت باکتریایی بر ضد آنتیمیکروبهای با منشأ گیاهی (PBA) بودهاند، ارائه نشده است.
اغلب PBAهای زیست-فعال مشتقات فنل هستند که رشد باکتریایی را با تغییر در نفوذپذیری غشاء آنها یا کاهش pH کنترل میکنند، با این حال، فعالیت آنها بهطورکلی ضعیف و اغلب غیراختصاصی است. گیاهان بهطورکلی این محصولات را در غلظتهای نسبتاً بالا برای حفاظت از خودشان در برابر پاتوژنها تولید میکنند، البته استثنائاتی در طبیعت مشاهده شده است. پلیآلتهآ نمورالیس یک گیاه دارویی چینی است که یک پیریتیون بهشدت اختصاصی تولید میکند که رشد قارچها و باکتریهای خاصی را مهار میکند. از نظر ساختاری بسیاری آنتیبیوتیکیهای فیتوشیمیایی شبیه آنتیبیوتیکهای کلینیکی هستند. کوینین، جداشده از پوستهی درخت سینچونا، یک شلاته کنندهی فلز با فعالیت بالا بر ضد گونههای پلاسمودیوم در درمان مالاریا است. فلوروکوینولونها از نالیدیکسیک اسید، از اجداد کوینینها گسترش یافتهاند. برخی موارد از اختصاصیت هدف در بین PBAها گزارش شده است. کومارینها فعالیت بالایی بر ضد استافیلوکوک ارئوس دارند درحالیکه هیچ فعالیتی علیه باکتریهای گرم منفی نشان نمیدهند. یکی از تأثیرات مشاهده شده، اثر باکتریکشی دستهای از PBAها بر روی MRSA است. در زیر تعدادی از این PBAها برشمرده میشوند، اما باید دانست که این PBAها صرفاً محدود به این موارد نمیباشند: عصارهی هستهی انگور، عصارهی برگ لوبیای پیچی، عصارهی برگ درخت بادام زمینی، عصارهی پوستهی درخت بادام زمینی، عصارهی پوستهی درخت انجیر، عصارهی پوستهی درخت هبیسکوس و عصارهی صنوبر کویینزلند
به نظر میرسد با توجه به نیاز فوری به داروهای ضدمیکروبی، گزارش کردن داروهای گیاهی ضد استافیلوکوکوس در مطالعات اخیر مورد توجه قرار گرفته است. از مطالعات برمیآید که PBAها گسترهای از عملکردها را در برابر بسیاری از پاتوژنها دارند. علیرغم این مسئله، ترکیبات گیاهی همچنان کمتر بهعنوان یک درمان کلینیکی آنتیبیوتیکی مدنظر گرفته میشوند.
گیاهان در بسیاری از انواع طب سنتی شامل آیوروِدا (یک روش طب سنتی هندی) و طب سنتی چینی (TCM) اهمیت اصلی دارند. بسیاری از گیاهان دارویی هندی که در طب سنتی استفاده میشوند خصیصههای ضدمیکروبی بارزی دارند. طبق یک گزارش دربارهی ۵۰ گیاه دارویی محبوب از ۲۶ خانوادهی مختلف، نزدیک به ۷۲% گیاهان فعالیت ضدمیکروبی در برابر باکتریهای گرم مثبت و گرم منفی نشان دادهاند. علیرغم این مطالعات، خصیصههای درمانی اکثر گونههای گیاهی در سرتاسر جهان باید مورد تحقیق قرار گیرند. مطالعات متعددی گزارش کردهاند که گیاهان دارویی هندی درجات نسبتاً بالایی از فعالیت ضدمیکروبی دارند. همچنین مطالعات مشابهی بر روی گیاهانی که عموماً در TCM استفاده میشوند، انجام شده است. بهعنوان مثال، گیاهان استفاده شده در TCM برای درمان زخم معده بهشدت در مقابل هلیکوباکتر پیلوری که مهمترین عامل مسبب زخمهای معدهای/ گوارشی است، مؤثر هستند. درحالیکه عمدهی مطالعات داروشناسی از آسیا سرچشمه میگیرند، محققان همچنین تأثیر گیاهان دارویی سنتی ملی را در سرتاسر جهان شامل مطالعاتی در امریکا، جنوب افریقا، استرالیا و ترینیداد و توباگو در کارائیب گزارش کردهاند،
در طی سالهای اخیر، پزشکی غرب شروع به تأیید مزایای گیاهان دارویی سنتی کرده است. یک گزارش اخیر توسط WHO، گیاهان دارویی را بهعنوان یکی از بهترین منابع بالقوهی داروهای جدید معرفی میکند. مثالهای متعددی از ترکیبات گرفته شده از گیاهان وجود دارد که بهعنوان مواد ضدمیکروبی مؤثر بودهاند. آرتمیسینین استخراج شده از گیاه آرتمیسیا آنوا خواص ضد مالاریا دارد و باعث نجات جان میلیونها نفر در سطح جهان شده است. رزوراترول که در انگور و گیاه ایتادوری یافت میشود تأثیرات باکتریواستاتیک بر روی باکتریهای گرم مثبت و گرم منفی دارد. بربریس آریستاتا و بربریس آسیاتیکا حاوی آلکالوئید بربرین هستند که خواص ضدباکتریایی دارد. با این حال، از تقریباً ۴۲۲٫۰۰۰ گونه گیاهی در سطح جهان، تخمین زده میشود که تنها بخش کوچکی (۱۰-۱%) از کل تعداد تخمینی داروهای گیاهی مشتق شده از این گونهها از نظر خواص ضدباکتریایی مورد آزمایش قرار گرفتهاند.
علیرغم افزایش قابلتوجه تعداد مقالات دربارهی گیاهان با خواص ضدباکتری و ترکیبات جداشده از آنها در سالهای اخیر، تنها تعداد خیلی کمی از داروهای مشتق شده از گیاهان مورد استفادهی پزشکی قرار گرفتهاند. این مسئله احتمالاً به این دلیل است که ترکیبات گیاهی اغلب نیازمند تأثیرات ترکیبی پیچیده برای افزایش فعالیت ترکیب زیست-فعال هستند، ازاینرو بررسی ترکیب مواد گیاهی با هم یا ترکیب مواد گیاهی با آنتیبیوتیکهای مرسوم ممکن است یک راه پربازدهتر برای تحقیقات باشد.
درمانهای شیمیایی ضدمیکروبی ترکیبی
راههای مختلفی برای جلوگیری، کاهش یا معکوس شدن مقاومت آنتیبیوتیکی موجود است و ثابت شده که استفاده از عصارههای گیاهان دارویی دارای خواص ضدمیکروبی یک روش نسبتاً مؤثر است. با این حال، یک راه ترکیبی که اجازهی تعامل سینرژیک بین عصارهی گیاهان و آنتیبیوتیکهای معمول را بدهد مؤثرترین روش برای مبارزه با مقاومت ضدباکتریایی است. در حال حاضر شواهدی مبنی بر بهبود عملکرد آنتیبیوتیکهای معمول بهواسطهی تأثیر سینرژیک با ترکیبات مشتق از گیاهان وجود دارد. ترکیب بتالاکتامها با آ-منگوستین جداشده از میوهی منگوستین یا با کورستین یا کامپرلو از میوههای مختلف، سبزیجات و دانهها عملکرد درمانی را در سویههای باکتریایی مقاوم به بتالاکتام بهطور مطلوبی افزایش داده است. اجزای مشتق شده از منگوستین این ترکیبات احتمالاً از عملکرد آنزیم بتالاکتاماز ممانعت کرده و در نتیجه آنتیبیوتیک را دوباره فعال میکند. حتی ترکیبات مشتق شده از گیاه که خودشان خصیصههای آنتیبیوتیکی دارند (بهعنوان مثال بربرین) مقاومت سودوموناس آئروجینوزا به آمینوگلیکوزید را کم میکند. در نتیجه، توانایی ترکیبات گیاهی برای دوباره مورد استفاده قرار دادن آنتیبیوتیکهای معمول در درمان عفونتهای میکروبی میتواند بهطور مشهودی بر سلامت جهانی از منظر مبارزه با میکروارگانیسمهای پاتوژن مقاوم مؤثر باشد. مثالهای بیشتر از ترکیبات مشابه در جدول ۵ نشان داده شدهاند.
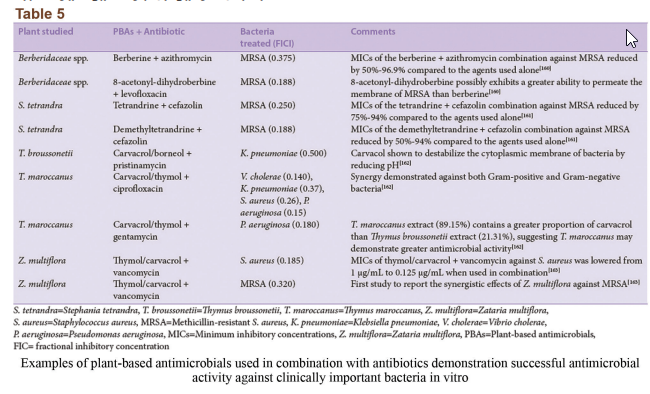
در مطالعات ارزیابی سینرژیکی، بر روی ترکیب دو یا چند دارو، به امید دستیابی به تأثیرِ کلیِ بهبود یافته، که به شکلی مشهود بزرگتر از جمع تأثیر اجزاء آنها بهصورت انفرادی باشد آزمایش میشود. اخیراً درمان ترکیبی، بهخصوص در زمینهی بیماریهای عفونی، بهطور گسترده به رسمیت شناخته شده است. بر طبق WHO، درمانهای ترکیبی به دلیل تواناییشان برای هدف قرار دادن عناصر متعدد یک بیماری و محدود کردن مقاومت در بیماریهای عفونی چندگانهی تهدیدکنندهی حیات مانند مالاریا، سل، و ایدز، به درمانهای تکی ترجیح داده میشوند. امروزه داروهای ترکیبی با محصولات طبیعی ضدمیکروبی، به دلایل متعدد از قبیل مزیت اقتصادی نسبت به روشهای معمول کشف دارو، یک اولویت تحقیقی شدهاند. در مقایسه با توسعهی یک داروی جدید که نیازمند سالها آزمایش گسترده است، یکی از اهداف درمان ترکیبی این است که میزان مقاومت را نسبت به داروهای موجود کاهش داده و در نتیجه آن داروها را دوباره مورد استفاده قرار دهد. بازگشت به آنتیبیوتیکهای مرسوم با استفاده از این ترکیبات، باعث میشود که داروی ترکیبی بسیار سریعتر و با هزینهی توسعهی بسیار کمتر به مرحلهی استفادهی کلینیکی برسد، چراکه اجزای بیواکتیو ترکیبات قبلاً از طریق مراحل کلینیکی گسترده ارزیابی شده بودند، بنابراین نیاز به آزمایشهای کمتری هست. از دیگر مزایای تعاملات سینرژیک، افزایش کارایی، کاهش عوارض جانبی، ثبات و افزایش قابلیت زیستی و نیاز به دوزهای کمتر در مقایسه با جایگزینهای سنتتیک است. ترکیبات عصارهی گیاهان/آنتیبیوتیک نهتنها اثر ضدمیکروبی کلی را بهبود میبخشند، بلکه میتوانند بهعنوان مواد بهبوددهنده/ تعدیل کنندهی مقاومت عمل کنند. برخی عصارههای گیاهی خام به غشاء سیتوپلاسمی باکتریهای مقاوم آسیب میزنند و منجر به از دست رفتن اجزای درون سلولی میشوند. یک مطالعهی جدید گزارش کرده که گونههای سالویا و ماتریکاریا رکوتیتا در ترکیب با اگزاسیلین تأثیرات سینرژیک داشته و کارایی آن را بهشدت افزایش میدهند. مکانیزم دقیق کاهش مقاومت آنتیبیوتیکی توسط این عصارهها هنوز نامشخص است. با این حال، محققان مطالعهی مذکور تصدیق کردهاند که این مسئله ناشی از یک تغییر ساختاری در مکانیزم مقاومت باکتری بوده است. عصارههای گیاهی در ترکیب با اگزاسیلین باعث آشفتگی غشاء سلولی میشوند.
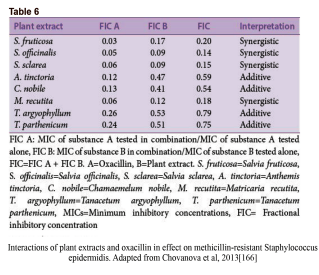
کلمهی سینرژی دلالت به این مسئله دارد که تأثیر نتیجه شده از یک ترکیب، بهطور مشهودی بزرگتر از جمع اجزای انفرادی آن است. با این حال، یک ترکیب از دو مادهی ضدمیکروبی ممکن است همچنین در دستههای دیگری چون همافزا، غیرتعاملی و آنتاگونیستی نیز تعریف شود. همافزایی هنگامی است که مواد افزوده شده به یکدیگر باعث بهبود یا افزایش کارایی یکدیگر شوند، هرچند نه بهاندازهی یک تعامل سینرژیک. در یک ترکیب غیرتعاملی (یا بیتفاوت)، اجزاء انفرادی ترکیب هیچ تأثیر افزوده یا آنتاگونیستی نشان نمیدهند. آنتاگونیسم زمانی است که یک ترکیب از مواد، تأثیر کلی کمتری از جمع تأثیر انفرادی موادش نشان دهد (به عبارتی دو دارو کارایی یکدیگر را کاهش دهند). اینکه تعامل سینرژیک را چگونه میتوان یا چگونه باید سنجید در بین محققین تفاسیر متعددی وجود دارد. با این حال، روش جدیدتر و پذیرفته شدهتر، استفاده از شاخص غلظت ممانعتکننده کسری (SFIC) (مشتق شده از حداقل غلظت مهارکننده [MIC]) و تحلیل ایزوبولوگرام (شکل۳a) در تفسیر نتایج سینرژیک است. یک نتیجهی سینرژیک SFIC≤۰٫۵ دارد، یک نتیجهی افزوده SFIC>۰,۵-۱.۰، غیرتعاملی SIFC>۱.۰-≤۴٫۰ و آنتاگونیست SFIC>۴.۰ دارد. مثالهای تأثیرات درمان یک سویه باکتریایی مقاوم با عصارهی گیاهان در ترکیب با اگزاسیلین در جدول ۶ نشان داده شده است.
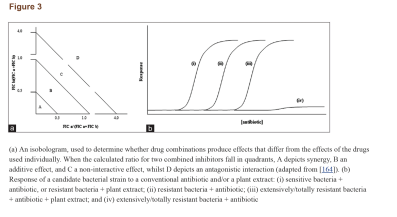
سینرژی: آیندهی مطالعات ضدمیکروبی؟
درمانهای ترکیبی میتوانند فعالیت مواد ضدمیکروبی ضعیف را علیه باکتریها بهبود بخشند (شکل۳b). آنتیبیوتیکهای ترکیبی برای درمان عفونتهای مقاوم، مؤثر گزارش شدهاند. یک داروی ترکیبی میتواند بر مکانیسمهای مقاومت باکتریایی غلبه کند و یا آنها را خنثی کند و در نتیجه با افزایش کارایی آنتیبیوتیکهای معمول، آنها را دوباره مؤثر و قابل استفاده نماید. شاید بهترین مثال شناخته شده از فعالیت سینرژیک آنتیبیوتیکها، ترکیب کلاولانیک اسید (یک مهارکنندهی آنزیمهای بتالاکتاماز مشتق شده از قارچ) با آنتیبیوتیکهای بتالاکتام است. در پاسخ به استفادهی اشتباه از آنتیبیوتیکهای بتالاکتام در طی یک دورهی طولانی، بسیاری از سویههای باکتریایی شروع به تولید آنزیمهای بتالاکتاماز کردند که ساختار حلقهی بتالاکتام این آنتیبیوتیکها را شکافته و آنها را بیاثر میکند. کلاولانیک اسید یک بتالاکتام ضعیف است که علیرغم دارا بودن یک حلقهی بتالاکتام مشابه با دیگر آنتیبیوتیکهای بتالاکتام، بهتنهایی فعالیت ضدمیکروبی بسیار جزئی دارد. شباهت در ساختار شیمیایی به مولکولهای کلاولانیک اسید اجازه میدهد تا بهطور برگشتناپذیر به بتالاکتاماز بچسبند و به این صورت آنزیم بتالاکتاماز را مهار کنند. یک داروی شیمیایی آنتیبیوتیکی به نام آگمنتین (ترکیب آموکسیسیلین و پتاسیم کلاولانات) نیز طراحی شده که دارای تأثیر سینرژیک است و برای استفادهی مجدد از آنتیبیوتیکهای بتالاکتام علیه باکتریهای مقاوم به بتالاکتام بسیار مؤثر است. در برابر مایکوباکتریوم توبرکلوزیس مشخص شده که ترکیب آنتیبیوتیکهای بتالاکتام مانند آموکسیسیلین با مهارکنندههای بتالاکتام مانند کلاولانیک اسید اساساً مؤثرتر از آموکسیسیلین بهتنهایی هستند، بهعلاوه ثابت شده که کلاولانیک اسید در ترکیب با آمپیسیلین، سفالوتین، سفالوریدین و سفامندول علیه استافیلوکوک ارئوس و انتروباکتریاسههای تولیدکنندهی بتالاکتاماز، سینرژی بیشتری دارند (MIC و حداقل غلظت کشندگی باکتری کاهش یافته). شواهد کافی مبنی بر این نکته موجود است که مهارکنندههای بتالاکتاماز میتوانند بهطور برگشتناپذیر به آنزیم متصل شده و منجر به افزایش کارایی بخش آنتیبیوتیکی ترکیب دارویی شوند.
میکروبها روشهای متعدد دیگری نیز برای ایجاد مقاومت به آنتیبیوتیکها گسترش دادهاند؛ شاید معمولترین این روشها، استفاده از پمپهای MDR است. این ایفلاکس پمپها از طریق کروموزوم کد میشوند و بهسرعت آنتیبیوتیکهایی که وارد سلول باکتریایی شدهاند را به خارج باکتری پمپ کرده و در نتیجه آنها را مقاوم به تأثیر آنتیبیوتیک میگردانند. یک پمپ بهتنهایی میتواند باعث شود که باکتری از انواع مواد ضدمیکروبی مختلف بگریزد. اگر عملکرد پمپها مهار شود، آنگاه غلظت آنتیبیوتیک درون سلول باکتری افزایش خواهد یافت و به دارو اجازه میدهد که بار دیگر مفید باشد. جالب است که بسیاری از گیاهان دارای مهارکنندههای پمپ MDR هستند تا فعالیت مواد ضدمیکروبی طبیعی خود را افزایش دهند. چنین مهارکنندههای پمپ MDR هنگامی که در ترکیب با برخی ترکیبات آنتیبیوتیکی که قبلاً غیرمؤثر/ متمایل به مقاومت شدهاند، استفاده شوند ابزارهای مهمی میشوند، بهعنوان مثال فعالیتهای سینرژیک برای بسیاری ترکیبات آنتیبیوتیک مرسوم/ تانینهای گیاهی علیه هر دو سویههای مقاوم و حساس اسینتوباکتر بایلی گزارش شدهاند. الاژیک اسید و تانیک اسید با حدود ۴ برابر افزایش در توانایی نووبیوسین، کلوروبیوسین، کومرمایسین، فوسیدیک اسید و ریفامپین در مقایسه با هر یک از این آنتیبیوتیکها بهتنهایی، تقویتکنندههای مؤثر آنتیبیوتیکهای متعددی بودهاند. جالب توجه است که نه الاژیک اسید و نه تانیک اسید از خودشان فعالیت ضدباکتریایی شایان توجهی ندارند، برعکس تأثیرشان روی دیگر آنتیبیوتیکها، هیچیک از این تانینها منجر به تقویت مشهود فعالیت تتراسایکلین نشدند. در آن مطالعه همچنین گزارش شده که فعالیت سینرژیک الاژیک اسید و تانیک اسید ناشی از مهار یک ایفلاکس پمپ MDR بوده است.
در کنار گسترش ایفلاکس پمپها، باکتریها همچنین میتوانند با تغییر در سایت هدف (ممانعت از اتصال آنتیبیوتیک) و با غیرفعال کردن دارو به فعالیت آنتیبیوتیک مقاوم شوند. اغلب باکتریها برای حفاظت از خود تعدادی از این راهها را با هم ترکیب میکنند. هر آنتیبیوتیک با مجموعهای از این مکانیسمهای عمومی غیرفعال میشود؛ بهعنوان مثال پنیسیلین، بیوسنتز دیوارهی سلولی را هدف میگیرد؛ درحالیکه کلرامفنیکل و اریترومایسین سنتز پروتئین را مهار میکنند. غشاء خارجی برخی باکتریها بهعنوان یک سد انتخابی عمل میکند؛ یعنی دارای پروتئینهای غشاء خارجی سرتاسری (انتگرال) هستند که برخی از آنها نقاط ورود و خروج برای آنتیبیوتیکها را فراهم میکنند. از دست دادن یا تغییر این پروتئینهای غشاء خارجی باعث کاهش نفوذپذیری و در نتیجه کاهش جذب آنتیبیوتیک شده، منجر به ایجاد مقاومت ضدمیکروبی میگردد. گسترهای از آنتیبیوتیکها شامل پنیسیلین و کلرامفنیکل بهطور ویژه به این مکانیسمهای مقاومت، حساس هستند. گزارش شده که ترکیبات گیاهی خاصی آشفتگی غشاء سلولی را القا میکنند و نفوذپذیری آنتیبیوتیک به درون سلول باکتریایی را افزایش میدهند. این آشفتگیهای غشایی، در کنار فعالیت بتالاکتامها بر روی ترانس پپتیداسیون غشاء سلولی، میتواند فعالیت مهارکنندگی آنتیبیوتیک را بهبود بخشد، بهعلاوه، برخی ترکیبات مشتق شده از گیاهان میتوانند فعالیت آنتیبیوتیکهای مهارکنندهی پپتیدوگلیکان را با حملهی مستقیم به جایگاه مشابه در دیوارهی سلولی بهبود بخشند.
مطالعات اخیر درباره ترکیبات سینرژیک از عصارههای گیاهی/ مواد آنتیبیوتیکی معمول
در طی دههی اخیر، تعداد مطالعاتی که به بررسی تعامل سینرژیک بین عصارههای گیاهی و آنتیبیوتیکهای مستعد به مقاومت میپردازند بهطور مشهودی افزایش یافته است. گیاه بومی سیسیل، بربریس آتننیس در تعامل با سیپروفلوکساسین دارای فعالیت سینرژیک است. عصارهی کلروفرم مشتقشده از برگهای بربریس آتننیس بهطور مشهودی MIC سیپروفلوکساسین را در برابر استافیلوکوک ارئوس، اشرشیا کلای و سودوموناس آئروجینوزا کاهش میدهد. یک ترکیب از آنتیبیوتیکها و عصارههای میخک، جامبولان، انار و آویشن فعالیت سینرژیک مشهودی علیه سویههای چندمقاومتی سودوموناس آئروژینوزا نشان داد. بهطور مشابه، در ترکیبات میخک- پنیسیلین و میخک- تتراسایکلین فعالیت ضدمیکروبی بهبودیافتهای به ترتیب علیه کلبسیلا پنومونیه و گونههای پروتئوس مشاهده شد. بهعلاوه، عصارههای خام بسیاری گیاهان دیگر در ترکیب با آنتیبیوتیکهای مختلف بهطور مشهودی میزان MIC را علیه سویههای مختلف مقاوم به داروی سودوموناس آئروژینوزا و ایزولههای کلینیکی MRSA کاهش میدهند. این مطالعات سینرژیک در نبرد علیه پاتوژنهای مقاوم به درمان بسیار امیدبخش بوده و همچنین نوید استفادهی مجدد از آنتیبیوتیکهایی را میدهد که عموماً بهتنهایی غیرمؤثر شدهاند.
سایر مطالعات جدید، تأثیرات سینرژیک جالبی در مورد دیگر ترکیبات گیاه/ آنتیبیوتیک گزارش کردهاند. ایزوفلاوونهای جدا شده از گیاه لاپینوس آرژنتئوس فعالیت آنتیبیوتیک طبیعی گیاهی بربرین و آنتیبیوتیک سنتتیک فلوروکوینولونی نورفلوکساسین را تقویت میکند. ایزوفلاوون از طریق مهار مکانیزم ایفلاکس (پمپ MDR) اجازه میدهد که غلظتهای بالاتری از بربرین درون سلولهای استافیلوکوک ارئوس تجمع یابند. بهطور مشابه، عصارههای مزونرون بنتامیانوم و سکورینگا ویروسا بهعنوان مهارکنندههای ایفلاکس پمپ (EPI) برای فلوروکوینولون، تتراسایکلین و اریترومایسین علیه سویههای مقاوم استافیلوکوک ارئوس (MRSA) عمل میکنند. همچنین عصارههای اتانول و کلروفرم مزونرون بنتامیانوم از سکورینگا ویروسا،MIC نورفلوکساسین را در برابر استافیلوکوک ارئوس چهار برابر کم کرد. گونههای بربریس به خاطر تولید بربرین آلکالوئیدی ضدمیکروبی شناختهشده هستند، اما همچنین یک مهارکننده ایفلاکس پمپ استافیلوکوک ارئوس تولید میکنند که بهعنوان ۵-متوکسی هیدنوکارپین (۵-MHC) شناخته میشود. ۵-MHC باعث کاهش مشهود MIC بربرین علیه استافیلوکوک ارئوس میشود که بهشدت کارایی آن را افزایش میدهد. بهطور مشابه، گزارش شده که عصارههای هلیکریسوم لنگیفولیوم فعالیت طیف گستردهای از آنتیبیوتیکها را علیه گونههای باکتریایی متعددی تقویت میکنند. درحالیکه مکانیزمهای سینرژیک در این مطالعه مشخص نشدهاند، نویسندهی مقاله پیشنهاد میکند که عصارههای هلیکریسوم لنگیفولیوم دارای ترکیبات اصلاحکنندهی مقاومت باکتریایی با طیف گسترده است.
در یک مطالعهی دیگر، برای عصارههای گونههای پتالوستیگما در ترکیب با آنتیبیوتیکهای متعدد، فعالیت سینرژیک گزارش شده است. عصارهی سویههای پتالوستیگما برای مهار رشد پروتئوس میرابیلیس بهطور سینرژیک با پنیسیلین، کلرامفنیکل و اریترومایسین تعامل میکند. سویهی پروتئوس میرابیلیس آزمایش شده در این مطالعه بهشدت مقاوم، کاملاً غیرحساس به کلرامفنیکل و اریترومایسین بوده و حساسیت کمی به پنیسیلین داشت. تمام این آنتیبیوتیکها مستعد به مقاومت در نتیجهی افلاکس پمپها هستند. یک ایفلاکس پمپ تکی میتواند برای باکتری، مقاومت به طیف گستردهای از آنتیبیوتیکهای با ساختارهای شیمیایی و ساختمانهای مختلف ایجاد کند و از طرفی برای یک ارگانیسم غیرمعمول نیست که بیش از یک ایفلاکس پمپ را کد کند. در نتیجه احتمالاً ترکیبات درون این عصارهها مکانیسمهای ایفلاکس را متوقف کرده یا پروسهی ایفلاکس را تغییر میدهند و با این کار طول عمر داروهای ضدباکتریایی موجود را افزایش داده و به این آنتیبیوتیکها اجازه میدهند تا دوباره از رشد سویهی پروتئوس میرابیلیس جلوگیری کنند. در حال حاضر هیچ داروی ترکیبی آنتیبیوتیک/EPI در بازار موجود نیست. با این حال، مطالعات متعددی اخیراً فعالیت EPI را برای تعدادی عصارههای گیاهی دیگر و ترکیبات مشتق شده از آنها گزارش کردهاند. یک مطالعهی تازه گزارش کرده که کارسونیک اسید جدا شده از رامارینوس آفیسینالیس، فعالیت اریترومایسین را تقویت میکند. این مطالعه مشخص کرده که این فعالیت افزایش یافتهی اریترومایسین، در اثر مهار پمپهای MDR باکتری توسط کارسونیک اسید بوده است.
احتمال دارد عصارههای گونههای پتالوستیگما که در مطالعهی ایلانکو و همکارانش بررسی شده، دارای یک مهارکنندهی برگشتناپذیر بتالاکتاماز باشد که برای مهار مکانیزم مقاومت آنتیبیوتیکی باکتری، مشابه با کلاولانیک اسید عمل میکند. سویهی پروتئوس میرابیلیس استفاده شده در این مطالعه احتمالاً بهعنوان جایگزین (یا علاوه بر ایفلاکس پمپها)، ژنهای کدکنندهی پروتئین متصلشونده به پنیسیلین با افینیتی پایین ۲a(PBP۲a) بدست آوردهاند که آنتیبیوتیکهای بتالاکتام را بیاثر میکند. در مطالعهای دیگر F-۱۰ بهعنوان یک جزء زیست فعال از گیاه دوابانگا گراندیفلورا شناسایی شد. F-۱۰ در این مطالعه نشان داده به همراه آمپیسیلین، برای مهار رشد MRSAها فعالیت سینرژیک دارد. بهعلاوه، تحقیقات صورت گرفته در مورد سایرمکانیزمهای ترکیبی نشان داده که در مهار PBP۲a نیز مؤثر است. برای تأیید این مسئله که ترکیب F-۱۰ و آمپیسیلین بهطورکلی بیان PBP۲a را در MRSA مهار میکند یا خیر از روش وسترن بلات استفاده شده و تأیید شــده که F-۱۰، ژنهای تنظیمکننده در بیان PBP۲a را مختل میکند. یک بررسی فیتوشیمیایی حضور فلاوونوئیدها و تانینها را در F-۱۰ آشکار کرده است. از آنجایی که PBPها یک گروه از آنزیمهای پروتئینی هستند، محتمل است که این مواد فیتوشیمیایی همکاریهای غیراختصاصی انجام داده و بیوسنتز سلول باکتری را تحت تأثیر قرار دهند.
مطالعهی ایلانکو و همکارانش همچنین عصارهی پتالوستیگمای هگزان با قطبیت کم را بهعنوان بلوکه کنندهی یک مکانیزم ایفلاکس پمپ دیگر در آسینتوباکتر بیلی شناسایی کرد. باکتری کاملاً به تتراسایکلین بهتنهایی مقاوم بود. همچنین، عصاره بهتنهایی در مقابل اسینتوباکتر بیلی غیرمؤثر بود، با این حال ترکیب عصاره با تتراسایکلین باعث تقویت خاصیت مهارکنندگی رشد باکتری شد. ایفلاکس پمپها عمدهترین مکانیزم مقاومت باکتریایی برای غیرفعال کردن تتراسایکلین هستند. در کل ۹ عدد سیستم ایفلاکس پمپ چنددارویی، شامل ایفلاکس پروتئین تت تتراسایکلین تنها در گونههای اسینتوباکتر شناسایی شده است. در نتیجه احتمال دارد که عصارههای با قطبیت کمتر بهعنوان مهارکنندهی ایفلاکس پمپ تتراسایکلین اسینتوباکتری بیلی عمل کنند. مطالعات مشابه بر روی ترکیبات جدا شده از یک گونهی متفاوت گیاهی (تیموس وولگاریس)، فعالیت شدید سینرژیک تری هیدروکسی فلاوون بیکالئین را هنگام استفاده بهصورت کنژوگه با تتراسایکلین علیه MRSA بیانکننده تت نشان داد. بیکالئین تنها یک فعالیت ضدباکتریایی ضعیف از خود نشان میدهد. جداسازی عصارههای گیاهی به کمک بیواسی، دیترپنهای متعددی (شامل کارنوسیک اسید) را با نقش تقویتکنندهی فعالیت تتراسایکلین علیه میکروبهای دارای مکانیزمهای ایفلاکس چنددارویی تت شناسایی کرد. بهطور مشابه، رسرپین (یک آلکالوئید گیاهی) جدا شده از رائولفیا وومیتوریا، فعالیت EPI مؤثری علیه ایفلاکس پمپ MDR باکتریایی که میانجی ایفلاکس تتراسایکلین در باسیلوس سوبتیلیس است نشان داد.
نتیجهگیری
موفقیتهای اولیه در درمان آنتیبیوتیکی نتایج نجاتبخشی به بار آورده و میتواند مثالی برای مهمترین پیشرفت علمی جهان در پزشکی جدید باشد. تأثیرگذاری آنتیبیوتیکهای استفاده شده علیه میکروارگانیسمهای بیشمار عفونی با ایجاد مقاومت میکروبی درست یک دهه پس از کشف پنیسیلین بهشدت کاهش یافته است. این مقاومت در حال پیشرفت، منجر به ایجاد عفونتهای باکتریایی شده که حالا کاملاً به تمام داروهای معمول که پیشتر قادر به از بین بردن عفونت بودند، مقاوم هستند. متعاقباً استفاده از رژیمهای درمانی سینرژیک ترکیب شده با عصارههای گیاهی یا ترکیبات تخلیص شدهی مشتق شده از گیاهان، یک حوزهی تحقیقی نوظهور و بسیار موردتوجه برای جامعهی پزشکی و علمی میباشد. جای تعجب نیست که بسیاری از این گیاهان، همانهایی هستند که جوامع بومی بهطور سنتی از آنها برای درمان بیماریهای عفونی استفاده میکردند. شواهد نشان میدهد که استفاده از عصارهی گیاهان، فعالیت ضدباکتریایی آنتیبیوتیکهای معمول را بهبود میبخشد و در نتیجه این آنتیبیوتیکها بهجای آنکه با داروهای جدید جایگزین شوند، میتوانند دوباره مورد استفاده قرار گیرند.
درمانهای سینرژیک دارای مزایای متعدد دیگری نیز هستند؛ بهطور مثال ترکیبات مشتق از گیاهان، برای اطمینان از غیرسمی بودنشان، پروسهی غربالگری راحتتری دارند، در نتیجه میتوانند با طی مراحل کوتاهتری به مرحلهی عرضه به بازار رسیده و در نهایت هزینهی تولید و آزمایش را کاهش دهند. این مسئله را پیشتر در ترکیب مهارکنندهی غیر آنتیبیوتیکی بتالاکتاماز (بهعنوان مثال کلاولانیک اسید) در کنار داروهای بتالاکتام دیدهایم که برای محافظت از آنتیبیوتیک در برابر آنزیمهای تخریبکننده عمل میکنند. چنین استراتژیهای درمانی نسبتاً اختصاصی بوده و تنها برای یک دستهی واحد (یا دستههای محدودی) از آنتیبیوتیکها مؤثر است، اما توسعه و استفاده از مهارکنندههای ایفلاکس پمپ میتواند تأثیر بیشتری داشته باشد، زیرا ازآنجاکه ایفلاکس پمپها اغلب آنتیبیوتیکهای متعددی را به بیرون از سلول میفرستند، مهارکنندهی ایفلاکس پمپها میتواند منجر به استفادهی مجدد از گسترهی وسیعتری از آنتیبیوتیکها گردد. در نتیجه، این مسیر پژوهشی در صورت به نتیجه رسیدن میتواند بسیار مفید باشد.
بااینکه ادامهی پژوهشها در حوزهی گسترش داروهای سینرژیک تازه و چهارچوبهای تازه همچنان ضروری است، استفاده از عصارههای مشتقشده از گونههای بیشمار گیاهی که در طب سنتی استفاده میشوند بهعنوان تقویتکنندههای سینرژیک داروهایی که پیشتر مؤثر بودهاند، نویدبخش یک عصر جدید در درمان بیماریهای عفونی با مقاومت بالا و تهدیدکنندهی جامعهی جهانی است. با حساس شدن دوبارهی این پاتوژنها به آنتیبیوتیکهایی که قبلاً بهدقت آزمایش شدهاند، این جدال علیه باکتریهای کشنده، فراگیر و قابل انتقال میتواند نهایتاً موفق بوده و به درمان کلینیکی این بیماریها منجر شود.
فراپژوهش