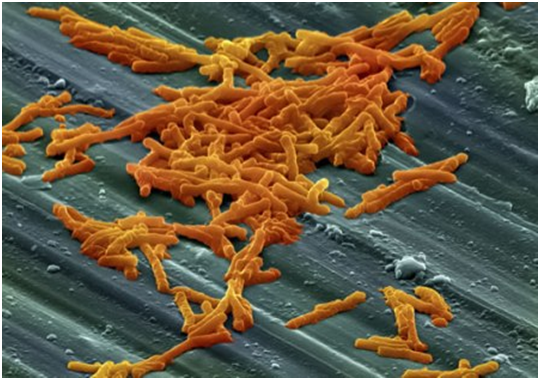
کلستریدیوم دیفیسیل متداولترین عامل عفونت در مراکز بهداشتی آمریکاست و در سطح جامعه هم نقش پاتوژنیک آن بیش از پیش در حال خودنمایی است. کلستریدیوم دیفیسیل با کسب سریع مقاومت نسبت به آنتیبیوتیک یکی از تهدیدات جدی سلامت عمومی جامعه میباشد. تظاهرات بالینی این عفونت میتواند از شکل بدون علامت و اسهال ملایم تا مگاکولون سمی و مرگ متغیر باشد. عفونت با کلستریدیوم دیفیسیل (CD) متعاقب dysbiosis ایجاد میشود. dysbiosis شرایطی است که در آن تعادل میکروبی دستگاه گوارش بهم میخورد و اغلب ناشی از درمان با آنتیبیوتیک و از بین رفتن برخی از فلور میکروبی میباشد. با از بین رفتن فلور طبیعی روده، کلستریدیوم دیفیسیل این فرصت را مییابد که تکثیر یافته و با تولید سم ایجاد بیماری نماید. در این نشست با چهار نفر از متخصصین در رشتههای مختلفِ مرتبط با موضوع به گفتگو نشستهایم تا از ایدههای آنان درخصوص چالشهای موجود در زمینه تشخیص، درمان و پیشگیری از عفونت کلستریدیوم دیفیسیل مطلع شویم.
Larry Kociolek: برای تشخیص کلستریدیوم دیفیسیل بهطور کلی دو روش وجود دارد: ۱- آزمایشهایی که توکسین آزاد را مورد شناسایی قرار میدهند و ۲- آزمایشهایی که میکروبهای مولد سم (سوشهای مولد سم کلستریدیوم دیفیسیل) را شناسایی میکنند.
روش cell culture cytotoxicity neutralization و کشت مدفوع توکسیژنیک که استاندارد طلایی برای شناسایی سم آزاد و سوشهای توکسیژنیک کلستریدیوم دیفیسیل میباشند، کارکرد بالینی محدودی دارند چرا که زمانبر (چندین روز) و پیچیده هستند، لذا این روشها عمدتاً در کارهای تحقیقاتی استفاده میشوند. در کار بالینی سنجش توکسین به روش EIA و آزمایشهای (NAATs) Nucleic Acid Amplification برای تشخیص کلستریدیوم دیفیسیل متداول هستند. گرچه شناسایی توکسین در CDI اختصاصیتر میباشد (یعنی بیشتر با بیماری علامتدار همراه است)، اما بهواسطه حساسیت پایین آن و احتمال پاسخ منفی کاذب بیشتر بیمارستانها آن را کنار گذاشتهاند.
اکنون در بیمارستانهای آمریکا NAAT معمولترین روش برای شناسایی کلستریدیوم دیفیسیل است. NAATs سریع و حساس بوده و انجام آن بسیار آسان است، لذا موارد منفی کاذب با روش NAAT بسیار غیرمحتمل میباشد، اما اشکال روش NAAT عدم افتراق بین عفونت کلستریدیوم دیفیسیل(بیماریزا) با کلونیزاسیون بدون علامت آن میباشد.

Erik Dubberke: در شناسایی CDI چالشهای متعددی وجود دارد؛ بیشتر این چالشها از آنجا ناشی میشود که عمده تحقیقاتی که روشهای شناسایی کلستریدیوم دیفیسیل را مقایسه میکنند از توجه به اطلاعات بیمار غافل هستند. بدون داشتن اطلاعات بالینی نمیتوان CDI را از کلونیزاسیون بدون علامت افتراق داد. فقدان اطلاعات بالینی این اثر را ناخواسته در پی داشته که اشتیاق زیادی برای بهینه کردن حساسیت روشهای تشخیص کلستریدیوم دیفیسیل ایجاد میشود. این مسئله سبب به وجود آمدن سه موضوع درهمتنیده شده که امروزه ما را آزار میدهد:
- نگرانی از اینکه سنجش توکسین بهاندازه کافی حساس نیست.
- انجام سه بار آزمایش (مثل موارد دیگر آزمایش مدفوع) برای کلستریدیوم دیفیسیل و
- عدم توجه به اهمیت (negative predictive value) NPV و PPV (positive predictive value) در تفسیر نتایج آزمایش کلستریدیوم دیفیسیل
حساسیت کشت کلستریدیوم دیفیسیل از مدفوع بهویژه اگر فرد ناقل بدون علامت باشد بهمراتب بیشتر از حساسیت تشخیص توکسین است.
سطح توکسین در فرد بدون علامت کمتر از میزان آن در CDI است. وقتیکه اطلاعات بالینی در دسترس نباشد، در خصوص افرادی که کشت مدفوع از نظر کلستریدیوم دیفیسیل مثبت است ولی توکسین منفی است، اینطور فرض میشود که آنها مبتلا به CDI هستند و منفی شدن آزمایش توکسین، منفی کاذب قلمداد میگردد.
از طرف دیگر با داشتن اطلاعات بالینی متوجه میشویم که بیشتر این موارد مربوط به کلونیزاسیون بدون علامت کلستریدیوم دیفیسیل است، اما نگرانی از پایین بودن حساسیت روش شناسایی توکسین سبب بهکارگیری روشهای اتوماسیون شده است. این مسئله ریشه در این دارد که به هنگام تفسیر نتایج آزمایش باید به NPV و PPV توجه داشت.
هر بار که به خاطر منفی شدن جواب، آزمایش تکرار میشود، شیوع CDI در جمعیت کاهش یافته و بنابراین PPV نیز کاهش مییابد. وقتیکه برای بار سوم آزمایش را انجام میدهیم احتمال اینکه پاسخ مثبت نشانگر مثبت واقعی باشد به کمتر از ۲۰% کاهش مییابد که بیانگر اهمیت بهای بیشتر PPV نسبت به حساسیت آزمایش است. در بیشتر آزمایشگاهها NPVی اولین آزمایش توکسین با روش EIA بیشتر از ۹۵% میباشد.
مطالعات محدودی که اطلاعات بالینی را لحاظ کردهاند نشان میدهند که ۳۵ تا ۵۰ درصد بیمارانی که از نظر کلستریدیوم دیفیسیل آزمایش شدهاند، از نظر بالینی اسهال قابلتوجهی نداشته و ۲۰ تا ۴۰ درصد آنها بهتازگی ملین مصرف نمودهاند. باید روشهای تشخیص کلستریدیوم دیفیسیل بر مبنای اطلاعات بالینی در ابتدای مراجعه بیمار و فرجام وی مقایسه شوند.
- روشهای تشخیصی که برای کلستریدیوم دیفیسیل استفاده میشوند چگونه میتوانند سبب رشد موارد CDI در یک بیمارستان شوند؟

Christopher Polage: انتخاب روش برای تأئید آزمایشگاهی CDI نقش مهمی در افزایش ظاهری آمار CDI در یک بیمارستان دارد چراکه بیش از ۵۰% افرادی که با کلستریدیوم دیفیسیل توکسیژنیک و اسهال بستری میشوند با روش ایمونواسی از نظر توکسین در مدفوع منفی هستند. در اغلب موارد علت این امر را عدم حساسیت کافی روش ایمونواسی برای تشخیص توکسین میدانند، اما تجربیات من نشان میدهد که در واقع علیرغم کلونیزه شدن کلستریدیوم دیفیسیل در روده بیمار، علت اسهال یک عامل ثانوی میباشد، لذا شناسایی توکسین در مدفوع بهتر از روشNAAT میتواند بیماری علامتدار را پیشبینی کند. آزمایشگاههایی که فقط از روش NAAT برای تشخیص CDI استفاده میکنند موارد مثبت بیشتری نسبت به استفاده از روش تشخیص توکسین دارند که البته این افزایش فقط از ماهیت روش ناشی میشود. بسیاری از آزمایشگاهها پس از آنکه از روش تشخیص توکسین به روش NAAT تغییر رویه دادند، میزان گزارشات CDI در آنها ۱/۵ تا ۲ برابر افزایش یافت.

Thomas Riley: نوع آزمایشی که برای تشخیص کلستریدیوم دیفیسیل بکار میرود قطعاً اثر مهمی در میزان آمار ظاهری CDI خواهد داشت.
مقالات متعددی که در دهه ۱۹۸۰ منتشر شدهاند تأکید میکنند که استفاده از روش EIA برای شناسایی توکسین کلستریدیوم دیفیسیل بهاندازه روش سنجش توکسیسیتی حساسیت ندارد و حساسیت روش سنجش توکسیسیتی هم کمتر از کشت توکسیژنیک است، معالوصف هنوز هم برخی آزمایشگاهها کورکورانه آزمایش غیرحساس EIA را برای تشخیص توکسین ادامه میدهند.، لذا فقدان حساسیت روشهای EIA برای تشخیص توکسین مانع میشود که از آنها بهتنهایی برای این نوع تشخیص استفاده شود، اما متأسفانه با پیشرفتهای اخیر در روشهای تشخیصی مولکولی در مورد کلستریدیوم دیفیسیل از آن طرف بام سقوط کردهایم، به این معنا که تشخیص بیشازحد (overdetection) کلستریدیوم دیفیسیل زیاد شده است.
انتقال از روش EIA به روش PCR سبب افزایش حدود دو برابری در نتایج مثبت CDI شده است، اما فیالواقع باید نتیجه واقعی را بین این دو قطب جستجو کرد. مهمترین نکتهای که در ارزیابی روشهای جدید تشخیص کلستریدیوم دیفیسیل باید مدنظر داشت ضرورت وجود همبستگی بالینی میباشد. مطالعات اخیر در امریکا و اروپا تأکید دارند که برای پیشبینی فرجام بیمار، نشان دادن سیتوتوکسین کلستریدیوم دیفیسیل در مدفوع بهوسیله کشت یا روشهای مولکولی ضرورت دارد. آنچه بهفوریت به آن نیازمندیم آزمایشی است که بتواند سیتوتوکسین مدفوع را با حساسیت بالا آشکار نماید.
- در بچهها CDI چقدر معمول است؟
Larry Kociolek: مطالعات اپیدمیولوژیک متعدد نشان میدهند که میزان CDI در بچههای آمریکایی در طی ۱۵ سال اخیر افزایش پیدا کرده است. مطالعات بسیار جدید در آمریکا و کانادا هم این موضوع را تأیید میکنند. مطالعات متعددی نشان میدهند که اکثر کودکان مبتلا به CDI در دوازده هفته قبل از عفونت بستری نبودهاند و لذا عفونت را از بیمارستان نگرفتهاند. در بیمارستان اطفالی که من در آن هستم، از زمانی که از NAATs برای تشخیص کلستریدیوم دیفیسیل استفاده میکنیم یعنی از سال ۲۰۰۹ بهطور مستمر CDI افزایش نشان میدهد.
با افزایش استفاده از آزمایشهای تشخیص CDI، میزان آن در جامعه افزایش نشان میدهد، درحالیکه CDI ناشی از عفونت بیمارستانی ثابت است. مکرراً مشاهده شــــــده است که در بین اطفالی که مبتلا به اسهال هستند و ریسک فاکتور CDI را ندارند و نیز کسانی که ابتلا به گاستروانتریت ویروسی دارند، آزمایشات CDI انجام میشود. این دادهها نشان میدهد که برای داشتن آمار صحیح CDI باید بین کودکان مبتلا به CDI با کسانی که ناقل کلستریدیوم دیفیسیل هستند و به دلیل دیگری دچار اسهال شدهاند افتراق قائل شد. برای درک بهتر شیوع واقعی CDI در اطفال نیازمند یک مطالعه آیندهنگر همگروه وسیع هستیم.
Thomas Riley: علیرغم فقدان شواهد خوب در خصوص کلستریدیوم دیفیسیل در اطفال، حقایق انکارناپذیری هم وجود دارند. نوزادان و اطفال کمسن به میزان بالایی در معرض کلونیزاسیون کلستریدیوم دیفیسیل هستند. وسعت این کلونیزاسیون بستگی به میزان آلودگی محیط تولد آنها دارد. نوزادانی که از شیر مادر استفاده میکنند احتمالاً بهواسطه حضور آنتیبادیهای مادر کمتر دچار کلستریدیوم دیفیسیل میشوند. وقتیکه فلور روده نوزادان به بزرگسالان شباهت بیشتری پیدا کرد (افزایش Firmicutes و Bacteroidetes) تعداد کلستریدیوم دیفیسیل کاهش مییابد. ظاهراً شیوع CDI در کودکان در طی یک دهه اخیر چه در جامعه و چه در بیمارستان افزایش یافته است، اما باید توجه داشت که در بزرگسالان هم وضع به همین منوال بوده است. بدیهی است که تحقیقات بیشتری برای پاسخ قاطع به این سؤال ضرورت دارد، اما شاید در این میان بهتر باشد که آزمایشگاههای تشخیصی توجه بیشتری نسبت به CDI در نوزادان و کودکان داشته باشند.
- کلونیزاسیون بدون علامت کلستریدیوم دیفیسیل چقدر شیوع دارد؟ آیا لازم است بیمارستانها نسبت به غربالگری بیمارانی که کلونیزاسیون بدون علامت دارند اقدام نمایند؟
Christopher Polage: کلونیزاسیون بدون علامت در بین افراد بزرگسال سالم که هیچ ریسک فاکتوری ندارند غیرمعمول است (کمتر از ۵%)، اما در افراد بستری حتی در بدو پذیرش در بیمارستان کاملاً معمول میباشد. میزان شیوع در بیمارستانها و جمعیتهای مختلف فرق میکند ولی مقالات منتشرشده حکایت از شیوع ۷ تا ۲۱ درصدی در بزرگسالان بستری دارند و نیز گفته میشود که ۴ تا ۱۵ درصد افراد در بدو بستری شدن کلونیزاسیون بدون علامت دارند. میزان کلونیزاسیون در نوزادان، افراد مبتلا به بیماری التهابی روده، بیماران بستری طولانی مدت و افراد بخش توانبخشی بیشتر از بقیه میباشد. ریسک فاکتورهای کلاسیک کلونیزاسیون، بستری شدن اخیر، مصرف آنتیبیوتیک و ابتلای قبلی به CDI میباشد. اخیراً ریسک فاکتورهای دیگری همچون چاقی، استفاده از داروهای مهارکننده پمپ پروتون PPI و هر موقعیتی که تعادل میکروبی روده را به هم بریزد، اضافه شدهاند.
سؤال سختتر این است که بپرسیم آیا بیمارستانها باید افراد را از نظر کلونیزاسیون بدون علامت غربالگری کنند یا نه؟ شواهدی در دست است که نشان میدهد ناقلین بدون علامت به انتقال کلستریدیوم دیفیسیل و شیوع CDI در بیماران بستری کمک میکنند، اما در خصوص اینکه چه میزان از منشأ CDI در بیمارستانها ناشی از ناقلین بدون علامت، بیماران علامتدار، ابتلای قبلی به CDI، آلودگیهای محیطی، پرسنل درمانی و یا تولید توکسین توسط سویههای آندوژن میباشد، دادههای زیادی در دسترس نیست.
در خصوص مؤثرترین و بهترین روش کاهش انتقال از افراد ناقل هم مطالعات کافی به عمل نیامده است. در نهایت باید شرایط و نوع نمونه و روشهای آزمایشگاهی بهینه برای غربالگری کلونیزاسیون کلستریدیوم دیفیسیل در افراد بدون علامت مشخص گردد، بنابراین درحالیکه نقش ناقلین بدون علامت در انتقال کلستریدیوم دیفیسیل روزبهروز بیشتر مشخص میشود اما پیشنهاد غربالگری نظارتی فعال بهعنوان یک روش روتین هنوز خیلی زود است.
Larry Kociolek: کلونیزاسیون بدون علامت اکنون بهخوبی در نوزادان و کودکان شناخته شده است. تخمین زده میشود که تا حدود ۷۰% نوزادان در سال اول حیات خود کلستریدیوم دیفیسیل را بهطور موقت از طریق مدفوع دفع میکنند. در سن سهسالگی نرخ کلونیزاسیون به ۳% کاهش یافته و در طی بقیه دوران کودکی و بزرگسالی ثابت باقی میماند، بنابراین احتمال دارد که ناقلین بدون علامت، کلستریدیوم دیفیسیل را منتقل نمایند؛ بهعنوان مثال در بزرگسالانی که اخیراً در تماس با مراکز درمانی نبودهاند تماس با نوزادان میتواند عامل خطر جهت ابتلا به CDI محسوب گردد.
غربالگری روتین تمام بیماران بستری بسیار هزینهبر بوده و بار کاری زیادی را بر آزمایشگاه تحمیل خواهد کرد. ازآنجاکه عواقب اقدامات احتیاطی در تماس با فرد آلوده بهخوبی شناخته شده است، لذا غربالگری روتین افراد ناقل و ایزوله کردن آنها احتمالاً اثرات زیانباری به همراه خواهد داشت. در اثر کاهش ارتباط بین کادر درمانی و بیمار، اقدامات مراقبتی با تأخیر انجام شده و عواقب سوء غیرعفونی بدنبال خواهد داشت، مضاف بر اینکه با افزایش نارضایتی بیمار افسردگی و اضطراب و اثرات سوء دیگر در پی خواهد آمد.
به نظر میرسد که خطر انتقال کلستریدیوم دیفیسیل از بیماران بدون علامت را با اقدامات استاندارد کنترل عفونت، همچون شستن دستها و ضدعفونی کردن گوشی پزشکی و سایر تجهیزات بتوان به حداقل کاهش داد، بنابراین تمرکز بر پیشگیری از عفونت و اقدامات کنترلی مقرون بهصرفهتر بوده و بر انتقال تمام بیماریهای عفونی مرتبط با مراکز پزشکی تأثیرگذار خواهد بود.
Erik Dubberke: میزان کلونیزاسیون در کسانی که در بیمارستان پذیرش میشوند بیشتر از افراد جامعه است و بین ۵ تا ۱۵ درصد میباشد. این عدد در کسانی که مدتی از بستری شدن آنها میگذرد به ۱۵ تا ۵۰ درصد افزایش مییابد. شیوع بالای کلستریدیوم دیفیسیل در بیماران بستری یکی به دلیل مصرف آنتیبیوتیک و دیگری مجاورت با افراد و محیط آلوده میباشد. اگر اقدامات لازم برای جلوگیری از انتقال CDI به عمل آید تنها ۲۰ تا ۳۰ درصد موارد انتقال را میتوان به منشأ فرد مبتلا به CDI منتسب کرد و لذا اهمیت انتقال از افراد ناقل بخوبی نمایان میگردد.
این دادهها و نیز برخی مطالعات مربوط به مدل انتقال کلستریدیوم دیفیسیل حکایت از آن دارند که شاید بشود در مراکز درمانی مانع انتقال کلستریدیوم دیفیسیل از ناقلین بدون علامت شد، اما در حال حاضر ناشناختههای بسیاری در خصوص سود و زیان و امکان پیشگیری انتقال کلستریدیوم دیفیسیل از افراد ناقل وجود دارد. اگر قرار باشد غربالگری ناقلین بدون علامت راهبرد پیشگیری از CDI باشد در گام اول ضروری است که روشی برای غربالگری انتخاب شود که سریع و حساس باشد. در این راستا سریعترین آزمایش برای ناقلین بدون علامت َNAATS میباشد.
متأسفانه حساسیت این روش برای شناسایی ناقلین بدون علامت ۶۰ تا ۷۰ درصد بیشتر نیست. حساسترین روش برای شناسایی ناقلین بدون علامت استفاده از محیط کشت غنیشده مایع است که متأسفانه ۳۶ ساعت زمان میبرد. اگر هرکدام از این روشها بهتنهایی برای غربالگری بکار روند در بهترین حالت احتمال تأثیر آن بر کاهش وقوع CDI در حد نسبتاً کم خواهد بود.
وقتیکه روش آزمایش مشخص گردید گام بعدی این است که با اطلاعات حاصل از آزمایش چه باید کرد. آیا باید همه ناقلین را در محدودیت تماس قرار داد؟ در این صورت آیا بیمارستانها این ظرفیت را دارند که حدود ۱۵% بیماران جدید را در قرنطینه قرار دهند؟ در اینجا احتمال بروز عواقب ناخواسته هم وجود دارد. پزشکان ممکن است متمایل به درمان ناقلین بدون علامت گردند که وقتی درمان متوقف گردد، خود این عمل منجر به افزایش CDI میگردد، بنا بر این ملاحظات و عوامل ناشناخته دیگر تا زمانی که نتوانیم اثرات غربالگری را بر وقوع CDI پیشبینی کنیم، بیمارستانها نباید نسبت به انجام غربالگری اقدام نمایند.
- آزمایشگاهها برای بهبود آزمایش کلستریدیوم دیفیسیل چه اقداماتی را میتوانند انجام دهند؟
Thomas Riley: پاسخ به این سؤال باید نسبتاً ساده باشد: انتخاب بیمار صحیح، نمونه صحیح و استفاده از آزمایش یا ترکیبی از آزمایشات صحیح. متأسفانه آنطور که به نظر میرسد کار سادهای نیست، اما اقدامات سادهای وجود دارد که انجام آنها سودمند خواهد بود. تمام آزمایشگاهها باید دستورالعملی داشته باشند که بر اساس آن مطمئن شوند فقط نمونههای اسهالی مورد آزمایش واقع خواهند شد. درصورتیکه از یک آزمایش با حساسیت بالا استفاده میشود نیازی به تکرار آزمایش وجود ندارد و نیز برای اطمینان از مؤثر بودن درمان نباید آزمایش را تکرار کرد.
مشکل اصلی این است که در حال حاضر هیچ آزمایش واحدی وجود ندارد که حساسیت و ویژگی لازم را توأمان دارا باشد و لذا یک رویکرد الگوریتمی ضرورت مییابد. این الگوریتم باید با الزامات هر آزمایشگاه متناسب گردد. هیچ راهحل منفردی برای همه موارد وجود ندارد. در این الگوریتم ابتدا باید یک آزمایش حساس استفاده شود و سپس با آزمایش بعدی توکسین آزاد شناسایی گردد.
Erik Dubberke: با توجه به تعداد آزمایشات غیرمتناسب که برای کلستریدیوم دیفیسیل در آمریکا انجام میشود و همچنین کمبود آشنایی با تفسیر نتایج آزمایشها، کارهای زیادی هست که آزمایشگاهها میتوانند برای بهبود آزمایش کلستریدیوم دیفیسیل انجام دهند. گام اول آموزش کلینیسینهاست که بدانند چه موقع باید درخواست آزمایش تشخیص کلستریدیوم دیفیسیل انجام شود، به این معنی که انجام این آزمایش محدود به مواردی گردد که شخص دچار اسهال قابلتوجه میباشد و نیز از تکرار آزمایش جهت اطمینان از بهبود خودداری شود.
از طرفی پزشکان باید بدانند که هیچ روش آزمایشگاهی قادر به افتراق CDI از ناقل بدون علامت نخواهد بود. آموزش بهتنهایی کفایت نمیکند، اغلب موارد لازم است تا تدابیری جهت تغییر رفتار و عملکرد وضعیت ایجاد شود؛ بهعنوان مثال آزمایشگاه باید از قبول نمونههای نامناسب بپرهیزد و نیز اجازه تکرار آزمایش و یا آزمایش جهت اطمینان از بهبود را به پزشکان ندهد. انتخاب بیمار چالش بزرگتری برای آزمایشگاه بشمار میآید. حتی اگر نمونه مدفوع غیراسهالی پذیرش نشود بسیاری از نمونههایی که برای کلستریدیوم دیفیسیل ارسال میشوند اسهال قابلتوجهی ندارند و یا اینکه اسهال آنها دلیل دیگری دارد. اینکه بتوان نمونه بیمار را جهت کلستریدیوم دیفیسیل بهطور اتوماتیک انتخاب یا رد کرد محتاج بررسیهای بیشتر است.
Christopher Polage: برای افزایش احتمال مثبت واقعی CDI و کاهش آزمایشهای غیرلازم و در نتیجه درمان غیرلازم ناقلین، آزمایشگاهها اقدامات زیادی را میتوانند انجام دهند. اقدام اول این است که تنها بر روی نمونههای اسهالی و بدون قوام آزمایش انجام شود. نمونه قبل از آزمایش باید بررسی شده و نمونههای غیراسهالی پس زده شوند. گام دوم برای کاهش موارد مثبت کاذب جلوگیری از تکرار آزمایش و ایجاد محدودیت برای نمونههای نوزادان زیر یک سال میباشد و در پایان برخی آزمایشگاهها به دنبال راهکاری هستند که با صحهگذاری به اینکه اسهالی بودن نمونه ناشی از ملین و مسهل نمیباشد، PPV بالینی نتیجه مثبت را افزایش دهند.
- نقش نظارت ضدمیکروبی در پیشگیری از CDI چیست؟
Thomas Riley: این سؤال جالبی است. مقالات متعددی نشان میدهند که تغییر در تجویز آنتیبیوتیکها بر کاهش میزان CDI مؤثر بوده است. اغلب این موارد در هنگام همهگیری و بهعنوان بخشی از اقدامات متعدد انجام شده و لذا مشکل است که موقعیت حاصله را صرفاً به نظارت ضدمیکروبی نسبت داد. البته در زمان همهگیری استفاده کمتر از آنتیبیوتیکی که نسبت به آن مقاومت وجود دارد معقول مینماید. در مورد کلستریدیوم دیفیسیل این به معنای کاستن از مصرف سفالوسپورینهاست که کلستریدیوم دیفیسیل ذاتاً به آن مقاوم است و نیز کاهش مصرف آنتیبیوتیکهای macrolide – lincosamide یا فلوروکوئینولون که متداولترین داروهایی هستند که کلستریدیوم دیفیسیل نسبت به آنها مقاوم میشود. اما درصورتیکه همهگیری در کار نباشد آیا اوضاع فرق میکند؟ در طی یک تحقیق انجام شده ما دریافتیم که نظارت آنتیبیوتیکی تأثیر اندکی در کاهش CDI دارد، درحالیکه رعایت بهداشت و ضدعفونی کردن، اثرات بهمراتب بیشتری در کاهش وقوع عفونت نشان میدهد.
Erik Dubberke: بهبود تجویز آنتیبیوتیک یک جزء کلیدی در هر برنامه پیشگیری از CDI بهحساب میآید، این اقدام در افراد بستری مصونیت جمعی ایجاد میکند و تعداد کسانی را که به CDI مبتلا میشوند کاهش میدهد. این پدیده بهنوبه خود سبب میشود که بیماران کمتری به گسترش عفونت کمک کنند.
نظارت آنتی میکروبی از دو طریق به پیشگیری از CDI کمک میکند:
- کاهش تعداد بیمارانی که در معرض داروهای ضدمیکروبی قرار میگیرند، اما اندیکاسیونی برای این کار ندارند.
- تغییر تجویز دارو برای افرادی که اندیکاسیون دارند.
آزمایشگاه جزء کلیدی در برنامه نظارت ضدمیکروبی محسوب میگردد.
Larry Kociolek: مطالعات متعدد نشان میدهند که مواجهه اطفال با آنتیبیوتیک قبل از تشخیص CDI نسبتاً کم میباشد و از این جهت این جمعیت موقعیت ویژهای دارند. در برخی مطالعات مواجهه با آنتیبیوتیک اطفالی که CDI را از جامعه گرفتهاند (نه از بیمارستان ) کمتر از ۵۰% ذکر شده است. ازآنجاییکه بیشتر کودکان مبتلا به CDI آن را از جامعه گرفتهاند، لذا در مقایسه با بزرگسالان برنامههای نظارت ضدمیکروبی در پیشگیری از CDI در اطفال چندان مؤثر نخواهد بود، اما به دلیل اینکه ارتباط محکمی بین CDI و مصرف آنتیبیوتیک وجود دارد، لذا اعتبار این دادهها را باید با شک و تردید مورد بررسی قرار داد. در بسیاری از مطالعات ممکن است اطفالی که کلونیزاسیون کلستریدیوم دیفیسیل در آنها وجود داشته بهعنوان مبتلا به CDI تلقی شده باشند. از طرفی در مطالعات گذشتهنگر مواجهه با آنتیبیوتیک چندان قابل بررسی نمیباشد، لذا اثر نظارت ضدمیکروبی در پیشگیری CDI در اطفال نیازمند بررسیهای بیشتر است.
فراپژوهش