چکیده:
الایزا (Enzyme Linked Immunosorbent Assay) بهعنوان یکی از مهمترین روشهای Immunoassay با کاربردهای فراوان در آزمایشگاه تشخیص طبی و تحقیقاتی نیازمند بازخوانی انواع روشهای کنترل کیفی و همچنین بررسی جوانب عمومی و اختصاصی تولید خطاهای احتمالی با آن است تا از صحت و دقت دادههای بهدستآمده اطمینان حاصل گردد. در این مقاله خلاصهای از جدیدترین یافتهها و دستاوردها در مورد الایزا شامل روشهای کنترل کیفی و همچنین ردیابی خطاهای احتمالی مورد بررسی قرار گرفته است.
مقدمه و تاریخچه:
در مواردی که واکنش آنتیژن– آنتیبادی قابلرؤیت نباشد باید به نحوی این واکنشها آشکار شود. این امر منجر به پدید آمدن نسل جدیدی از روشها به نام Labeled Immunoassay شد. در این واکنشها، آنتیبادی یا آنتیژن توسط موادی نشاندار میشد. قبل از توسعه الایزا، تنها راه برای انجام آزمایش بررسی واکنش آنتیژن و آنتیبادی روش radioimmunoassay بود. در این روش با استفاده از آنتیژن یا آنتیبادی نشاندارشده با رادیواکتیو که سیگنال را فراهم میکند، نشان میدهند که آیا کمپلکس یک آنتیژن یا آنتیبادی خاص در نمونه وجود دارد یا خیر.
این روش ابتدا در مقاله علمی Rosalyn Sussman Yalow و Berson در سال ۱۹۶۰ منتشر شد، اما وجود خطرهای فراوان کار با مواد رادیواکتیو محققان را بر آن داشت تا روشی جایگزین جهت ردیابی واکنش آنتیژن- آنتیبادی را دنبال کنند. به همین منظور طی پژوهشهای متعدد، تکنیک جایگزین برای انجام این کار توسط Wide و Jerker Porath در سال ۱۹۶۶ معرفی شد و در سال ۱۹۷۱، Peter Perlmann and Eva Engvall در دانشگاه استکهلم در سـوئد و Anton Schuurs and Bauke van Weemen در هلند بهطور مستقل مقالههایی را منتشر کردند که این دانش را به روشهای انجام EIA /ELISA تبدیل کرده است (۱).
در این مقاله با توجه به حجم دادهها و اطلاعات موجود، همچنین عدم وجود پژوهشهای کاربردی در زمینه کنترل کیفی، تکنیک الایزا به جمعآوری زمینههای اصلی و کاربردیترین روشهای کنترل کیفی و اندازهگیری صحت و دقت آن پرداخته شده است و از متنها و گزارشهای منتشرشده سنجههای اداره امور آزمایشگاهها همچنین دستورالعملهای آزمایشگاه رفرانس در مقایسه و تطبیق با متدهای مورد استفاده جهانی استفاده شده است تا تمامی جوانب کنترل کیفی در آزمایشگاه تشخیص طبی و تحقیقاتی بهطور جامع بررسی انجام شده باشد. در همین راستا ابتدا با استفاده از پایگاههای اطلاعاتی نظیر PubMed و مقالات منتشرشده در آن، اصول اولیه و مفاهیم کاربردی شرح داده شده، سپس با مطالعه مقالات منتشرشده و دستهبندی روشها و دستورالعملهای انجامشده با مقایسه دستورالعملهای منتشرشده توسط آزمایشگاه رفرانس به جمعبندی رسیده و از آنها در این مقاله استفاده شده است.
تعریف:
ELISA نام عمومی برای اینگونه روشها است که بهصورت رایج استفاده میشود و به عبارتی ارزیابیهای سنجش ایمنی آنزیمی که در آنها آنتیبادی یا آنتیژن بر روی یک فاز جامد Coat میشود به نام الایزا شناخته شده است.
در این روش با ایجاد کمپلکس آنتیژن-آنتیبادی در سطح میکروپلیت با استــــــــفاده از آنزیم نشاندارشـــده و TMB (Tetramethylbenzidine) که همان سوبسترا بوده، ایجاد سیگنال کرده و با رسم نمودار استاندارد بر اساس غلظت و جذب نوری محاسبهشده مقدار آنالیت موردنظر را محاسبه میکنند. در این روش بجای رادیو ایزوتوپ برای نشاندار کردن، از یک آنزیم استفاده میشود. چنانچه آنتیژن نشاندار شود EIA (Enzyme Immunoassay) و اگر آنتیبادی نشاندار شود IEMA (Immunoenzymometric Assay) نامیده میشود.
بهطور کلی در ساختار توضیحدهنده، انجام واکنش توسط یکی از شرکتهای سازنده کیت الایزا و تیم کنترل کیفی منتشرکننده مقاله به مقایسه این دو روش کاربردی و ارزیابی هرکدام پرداخته شده است (۲).
مزایای روش IEMA نسبت به EIA
۱- سهولت نشاندارسازی:
با توجه به اینکه در روشEIA ، مولکولهای آنتیژن اغلب از جنس هاپتن بوده که مولکولهایی با جرم مولکولی کمتر از هزار دالتون میباشند، لذا محدودیت گروههای عاملی در مولکولهای موردنظر، نشاندارسازی را محدود ساخته و اغلب نیاز به واکنشهای تخصصی و پیچیده دارد، اما در روش IEMA چون نشاندارسازی بر روی مولکول بزرگ آنتیبادی صورت میگیرد که دارای انواع گروههای عملکردی است، لذا نشاندارسازی آن بهراحتی با روشهای ساده و عمومی امکانپذیر است (۳).
۲- افزایش ویژگی:
در روش EIA با توجه به اینکه از یک آنتیبادی برای شناسایی منفرد استفاده شده، درحالیکه در روش IEMA استفاده از دو آنتیبادی امکان شناسایی مضاعف را میسر میسازد، ازاینرو ویژگی IEMA نسبت به EIA بیشتر است.
۳- افزایش حساسیت:
با توجه به اینکه در روش IEMA به ازای تکتک آنالیتها، کمپلکس نشاندار وجود داشته و همچنین جایگاههای نشاندارسازی بالقوه آن بیشتر است، لذا هم بدلیل رابطه یکبهیک بین آنالیت و کمپلکس نشاندار و هم بیشتر بودن جایگاههای بالقوه نشاندارسازی، حساسیت روش IEMA نسبت به EIA بیشتر است.
۴- کاهش زمان انکوباسیون:
با نظر به اینکه واکنش آنتیژن و آنتیبادی یک واکنش تعادلی دوطرفه بوده که طبق اصل لوشاتلیه با افزودن هر یک از مواد در یکی از طرفین معادله، تعادل به سمت طرف دیگر پیشرفت مینماید، ازاینرو بدلیل اینکه در روش IEMA غالباً رقابت وجود نداشته و برای حصول اطمینان از کفایت آنتیبادیها بهمنظور تشکیل کمپلکس در غلظت بالای آنالیت، همواره مقادیر زیادی از آنتیبادی بکار میرود؛ در نتیجه غلظت بالای مواد اولیه، سرعت به تعادل رسیدن یا زمان انکوباسیون را کاهش میدهد.
۵- افزایش محدوده عملکرد:
محدوده عملکرد که محدوده قابل اندازهگیری برای آنالیت بوده و فاصله بین اولین و آخرین نقطه استاندارد را شامل میشود، در روش IEMA حدود صد برابر بیشتر از EIA است (۴)، بنابراین ارجحیت تکنیک IEMA در تولید کیتهای نسل جدید الایزا مورد توجه قرار گرفته، اما همچنان در بعضی از تستها از روش EIA در جهت ارزیابی فرآیند و کنترل کیفی آنها استفاده میشود. امروزه در آزمایشگاههای تحقیقاتی و تشخیص طبی اساس کار و طراحی کیتهای آزمایشگاهی بر اساس ۳ رویکرد کلی و دستهبندی آنها انجام میشود:
طبقهبندی الایزا:
- Indirect Elisa (الایزای غیرمستقیم)
- Sandwich Elisa (الایزای مستقیم یا ساندویچی)
- Competetive Elisa (الایزای رقابتی)
الایزای ساندویچ:
در این روش آنتیبادی اختصاصی در کف میکروپلیتها کوت میشود. در ادامه، نمونه مورد بررسی که حاوی آنتیژن با غلظت نامعلوم است و یک سری محلولهای استاندارد که غلظت آنتیژن آنها معلوم است به حفرات جداگانه اضافه میشوند تا به آنتیبادی متصل گردند. پس از انکوباسیون به مدت زمان کافی، در صورت حضور آنتیژن در نمونه، آنتیبادی میچسبد. آنتیژنهای متصلنشده پس از شستشو حذف میشوند و آنتیبادی دوم که اغلب پلیکلونال است، با آنزیم نشاندارشده به حفرات اضافه میشود. آنتیژن مثل یک پل عمل میکند و لذا هرچه آنتیژن بیشتری در محلول آزمون یا استاندارد وجود داشته باشد، آنتیبادی دوم بیشتری متصل میشود.
پس از گذشت زمان انکوباسیون معینشده برای این مرحله و شستشو و حذف آنتیبادیهای دوم نچسبیده،HRP در بافر مناسب و غلظت تعیینشده اضافه میگردد و زمانی برای اتصال آن به آنتیبادی دوم داده میشود. برای افزایش قدرت اتصال آنزیم به آنتیبادی دوم از قدرت تقویتکنندگی بیوتین-آویدین، بیوتین-استرپتواویدین و یا لکتین-لیگاند و … استفاده میشود. البته در برخی از کیتها آنتیبادی دوم از قبل با آنزیم نشاندار شده (Conjugation) است که در این حالت بهدلیل اینکه آنزیم از قبل به آنتیبادی دوم چسبیده است زمان انکوباسیون برای آنتیبادی دوم و آنزیم یکی میشود (شکل ۱-۱).
پس از شستشوی نهایی که مهمترین شستشوی یک الایزا است چرا که در صورت باقی ماندن کمترین مقدار آنزیم نچسبیده میتواند موجب ایجاد رنگ اضافی در مرحله بعدی گردد، در مرحلهی بعدی برای اینکه سوبسترا بر اثر آنزیم محصول رنگی تولید نماید باید با یک رنگزا (کروموژن) همراه باشد. با اضافه کردن سوبسترا و دادن زمان مناسب جهت انجام واکنش، رنگزایی انجام میشود، سپس با اضافه نمودن محلول متوقفکنندهStop Solution (Sulfuric Acid) و تولید رنگ زرد، میزان تشکیل رنگ نشانگر میزان آنتیژن در نمونه آزمون است. در نهایت رنگ تولیدشده توسط دستگاه خوانده میشود. از جذب نوری محلول رنگی ایجادشده در چاهکهای مربوط به محلولهای استاندارد استفاده میشود تا منحنی میزان جذب نوری به غلظت آنتیژن در استانداردها رسم شود و نهایتاً با رسم نمودار میتوان با بردن جذب نوری محلول رنگی ایجادشده در چاهکهای مربوط به نمونهها، مقدار آنتیژن را بهصورت دقیق محاسبه نمود (شکل ۲-۱).
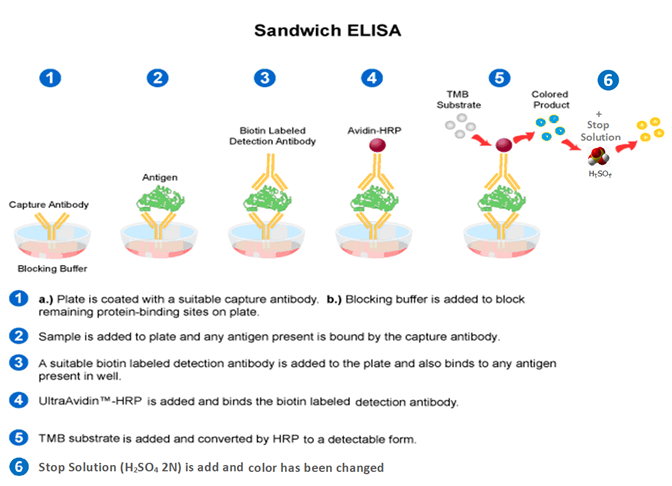
شکل (۱-۱): نمای کلی واکنش آنتیژن و آنتیبادی در الایزای ساندویچ
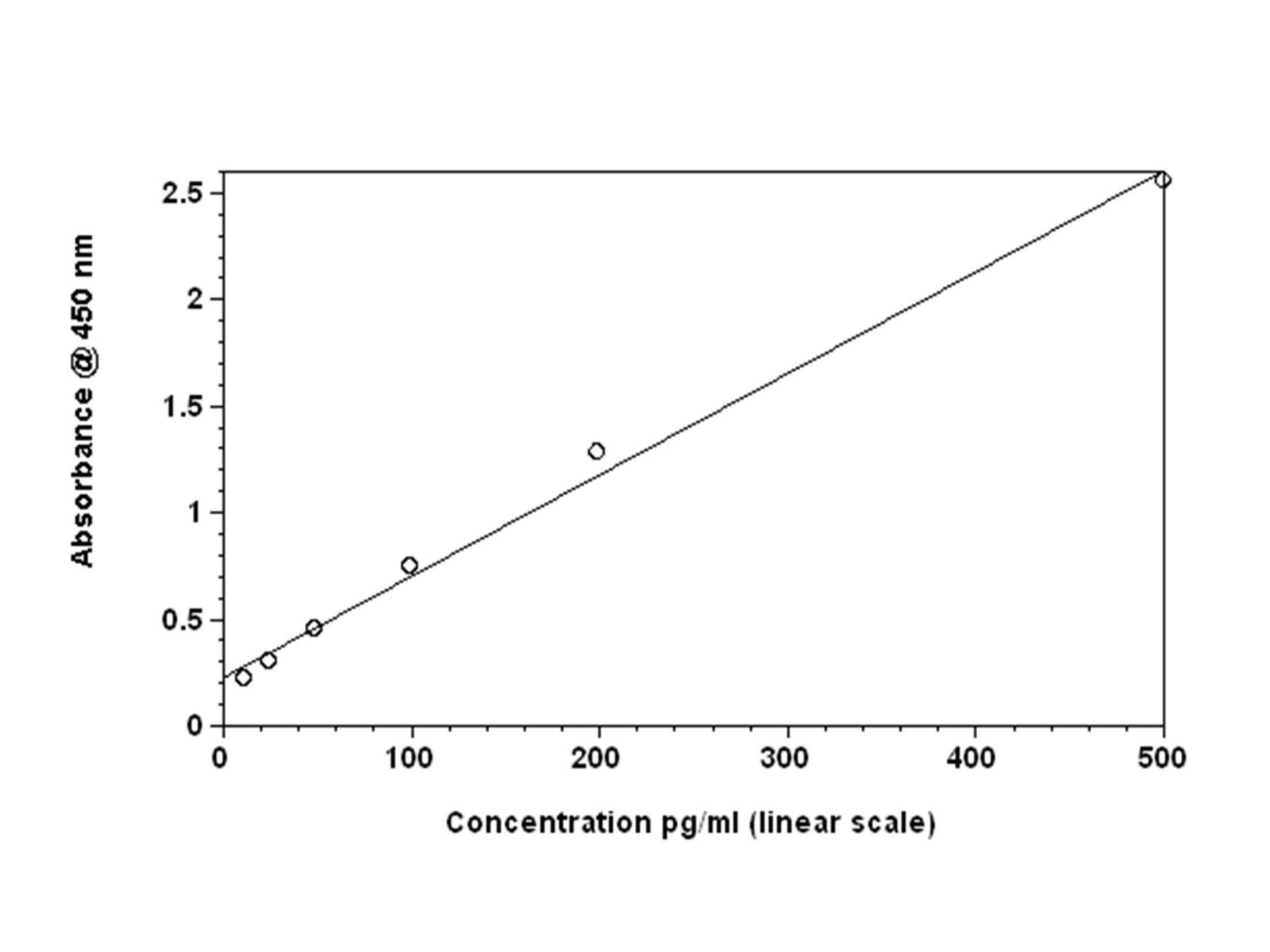
شکل (۲-۱): نمودار نتایج حاصله از الایزای مستقیم برحسب غلظت/ جذب نوری
الایزای غیرمستقیم
برای تعیین آنتیبادی اختصاصی و یا تیتراسیون آنتیبادی در نمونههای سرمی استفاده میشود. در این واکنش آنتیژن اختصاصی به جدار چاهکها (از جنس پلیاستیرن) متصل شده (کوت میشود) و سپس نمونه حاوی آنتیبادی به چاهکها اضافه میشود. پس از افزودن نمونه و طی زمان انکوباسیون، شستشو انجام شده و سپس آنتیهیومن گلوبولین نشاندارشده با آنزیم به چاهک اضافه میشود (شکل ۳-۱).
اختصاصیت روش بستگی به آنتیژن کوتشده در چاهکها دارد. برای جلوگیری از جذب غیراختصاصی پروتئینهای موجود در سرم و جلوگیری از اشغال نقاط اتصال آنتیژن، نمونه بهوسیله بافر رقیقکننده رقیق میشود.
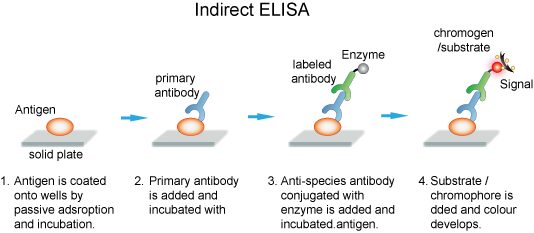
شکل (۳-۱): الایزای غیرمستقیم با اتصال آنتیبادی اختصاصی موجود در نمونه به آنتیژن کوتشده
الایزای رقابتی یا مهاری:
در روشهای رقابتی، اساس سنجش بر رقابت دو آنتیژن یا دو آنتیبادی (که یکی از آن دو نشاندار است) برای اتصال به لیگاند با مقدار محدود استوار است. اگر هر دو آنالیت نشاندار و غیرنشاندار با هم به سیستم اضافه شوند، روش را رقابتی مینامند، ولی چنانچه ابتدا آنالیت اضافه شده و پس از یک دوره انکوباسیون آنالیت نشاندار اضافه گردد روش را مهاری یا بالکینگ مینامند. در روش مهاری ممکن است در بین ۲ مرحله و قبل از اضافه نمودن آنالیت بعدی شستشو انجام شود یا انجام نشود. مثال بارز روشهای رقابتی و مهارتی سنجش T۳،T۴ است. انواع روشهای رقابتی عبارتند از:
الف) روش رقابتی یا مهاری برای آنتیژن:
اساس این روش بر رقابت بین آنتیژن نشاندار و آنتیژن موجود در نمونه برای اتصال به یک آنتیبادی اختصاصی کوتشده در چاهک استوار است. در این روش مقدار آنتیبادی کوتشده باید محدود باشد و ملکول سیگنالدهنده همان آنتیژن نشاندار است، اساس RIA و EIA کلاسیک بر همین روش استوار است (۵).
در این روش منحنی پاسخ دوز بهصورت معکوس خواهد بود؛ بدین معنی که آنالیت نشاندار در حضور مقادیر زیادی از آنالیت غیرنشاندار موجود در نمونه به مقدار کمتری به آنتیبادی متصل میشود و در نتیجه سیگنال هم بوجود میآید.
محدوده تعیین آنالیت با این روش ممکن است بهوسیله استفاده از مولکول نشاندار با فعالیت اختصاصی زیاد تقویت شود، اما حداقل مقدار قابل تشخیص (کمترین مقدار از آنالیت که قابل تشخیص خواهد بود) توسط تمایل آنتیبادی مورد استفاده تعیین میشود، با این وجود غلظتهای خیلی کم از هاپتنها عموماً توسط همین روش قابل تعیین هستند.
در برخی از موارد، نشاندار کردن روی خصوصیات هاپتن اثر میگذارد، در نتیجه در روش رقابتی برای تعیین آنتیژن از یک آنتیبادی نشاندار استفاده میشود، در این نوع از سنجشها ضروری است که فاز جامد توسط آنتیژن با مقدار کم و ثابت پوشیده شود، در این روش آنالیت موجود در نمونه با آنالیت کوتشده در چاهک برای اتصال به آنتیبادی نشاندار رقابت میکند. در اینجا هم منحنی استاندار معکوس است، از این روش بیشتر برای سنجش به روش کمیلومینسانس استفاده میشود (۶).
ب) روش رقابتی برای آنتیبادی:
در این روش بین دو آنتیبادی یکی در نمونه بهصورت غیرنشاندار و یکی بهصورت نشاندارشده با آنزیم برای اتصال به یک آنتیژن فیکسشده در چاهک رقابت صورت میپذیرد، بدیهی است هر چه مقدار آنتیبادی نمونه بیشتر باشد، آنتیبادی نشاندار کمتری به چاهکها متصل شده و سیگنال نیز کمتر خواهد بود و در نتیجه منحنی استاندارد نیز معکوس است شکل (۴-۱).
شکل (۴-۱): نمودار حاصل از نتایج الایزای رقابتی با رابطه معکوس جذب نوری/ غلظت
کنترل کیفی الایزا:
کنترل کیفیت در آزمایشگاه به کلیه روشها و دستورالعملهایی گفته میشود تا نتیجه فرآیند هم از نظر دقت و هم از لحاظ صحت مورد تأیید قرار بگیرد، به همین منظور در رابطه با تست الایزا مباحث کنترل کیفی در موارد زیر دنبال میشود:
۱- برای شناسایی تمامی دادههای غیر قابل قبول
۲- برای ردیابی روند نتایج (دور شدن از نمودار کنترل)
۳- برای تحقق بخشیدن به الزامات لازم برای شناخت خارجی که آزمونها در سطح قابل قبول انجام میشود (زمانی که نتایج برای اهداف تجاری بینالمللی مورد استفاده قرار میگیرند، مهمتر است (۲).
تعیین شاخصهای عملکردی کیتهای الایزا
حساسیت تشخیصی (Diagnostic sensitivity)
شامل تعداد افراد بیماری است که دارای آزمایش مثبت هستند و ارزش اصلی آن شناساندن افراد بیماری است که نتیجه آزمایش منفی دارند (گروه منفی کاذب).
ویژگی تشخیصی (Diagnostic specificity)
ویژگی تشخیصی شامل تعداد افراد غیربیمار است که آزمایش منفی دارند و ارزش اصلی آن تعیین افراد غیربیماری است که نتیجه آزمایش مثبت دارند (گروه مثبت کاذب).
روش اندازهگیری ویژگی تشخیصی و حساسیت تشخیصی در کیتهای الایزا
۱- اندازهگیری بر روی تعداد زیادی نمونه سرم کنترل مثبت و منفی (یا سرم رفرانس)
۲- جداسازی افراد بیمار از غیربیمار با روشهای استاندارد و مرجع
۳- مقایسه دو روش اندازهگیری معمول و روش مرجع و محاسبه آماری شاخصها (۴)
شاخصهای اجرایی در کیتهای الایزا
نخستین گام در ارزیابی کیتهای الایزا تعیین شاخصهای اجرایی برای آن است.
این شاخصها از نظر تعریف شامل کلیه آزمایشهایی هستند که دقیق و صحیح بودن عملکرد یک کیت را نشان میدهند. بسته به کمی یا کیفی بودن کیتهای الایزا این شاخصها متفاوت هستند. در کیتهای کمی در مرحله نخست پس از اطمینان از درست بودن منحنی استاندارد کیت و منطبق بودن آن با منحنی معرفیشده از سوی سازنده اقدام به بررسی شاخصهای اجرایی مینمایند (۷).
این شاخصها به ترتیب عبارتند از:
۱- دقت یا بررسی تکرارپذیری کیت (precision)
۲- صحت یا بررسی صحیح بودن (Accuracy)
۳- حساسیت
دقت (precision)
نخستین معیار مهم در شاخصهای اجرایی مسئله دقت در کیتهای آزمایشگاهی است. دقت به معنی تکرارپذیری یک آزمایش است. برای محاسبه آن در اولین مرحله نیاز به تهیه یک نمونه ثابت داریم. این نمونه میتواند پولد سرم (مخلوط سرمی)، سرم کنترل تجاری، سرم کنترل کیت یا هر نمونهای باشد که مقدار پایدار و ثابتی دارد. دومین نکتهای که بهتر است به آن توجه شود این است که بهجای یک نمونه، سه نمونه را بهصورت جداگانه مورد آزمایش قرار دهیم. این سه نمونه در اصل حاوی مقادیر بالا، متوسط و پایین آنالیت موردنظر ما خواهند بود و این اطمینان را به ما میدهند که در این سه طیف، کیت دارای نتایج تکرارپذیری است. پس از تهیه نمونه، دومین اقدام تعریف سطح تکرارپذیری یا در اصل طبقهبندی دقت است؛ از همین رو دقت را میتوان به انواع مختلفی طبقهبندی کرد:(۴)
درون سنجی (intra-assay)
در این نمونه دقت، میبایست با یک نمونه، وضعیت تکرارپذیری را در طی یک آزمایش کاری و درون یک پلیت مورد ارزیابی قرار داد. این نوع دقت توانایی یک روش را برای تعیین مقدار یک نمونه در یک آزمایش ارزیابی مینماید.
برای انجام این کار چندین استریپ از یک پلیت را با یک نمونه مورد آزمایش قرار میدهیم (حداقل۲۰ بار ) و نتایج حاصله را ثبت میکنیم. جهت محاسبه میبایست دقت نمود تا از غلظت بدستآمده و نه OD ، جهت محاسبات استفاده نماییم، از همین رو نخست میانگین کلیه غلظتها X را محاسبه نموده و انحراف استاندارد (SD) آنها را بدست میآوریم. با تقسیم انحراف استاندارد بر میانگین و ضرب آن در عدد۱۰۰، ضریب تغییرات (CV%) بدست میآید که نشاندهنده میزان پراکندگی نتایج بدست آمده است.
CV% = SD/ X × ۱۰۰
با ترسیم ضریب تغییرات در غلظتهای مختلف میتوان منحنیی بدست آورد که آن را گزارش دقت PRECISION PROFILE مینامند و میتوان از آن برای تعیین طیف کاری که بیشترین میزان تکرارپذیری را دارا باشد، استفاده نمود (دستورالعمل آزمایشگاه رفرانس).
میان سنجی (Inter-assay)
اهمیت این نوع دقت در این نکته است که توانایی یک روش را در تعیین مقدار یک نمونه در طی آزمایشا ت متعدد میسنجد.
برای تعیین این نوع دقت دو راه وجود دارد:
روش نخست در طی دو آزمایش مختلف در طی یک روز و با فاصله ۲ ساعت از یکدیگر انجام میگیرد. برای تعیین این نوع دقت که مشهور بهدقت مابین آزمایشی between -Run Precision است، میبایست در هر بار انجام آزمایش هر نمونه را چهار بار مورد آزمایش قرار داد و محاسبات نیز همانند قبل انجام میگیرد.
در روش دوم مابین روزهای مختلف نتیجه آزمایش را بررسی میکنیم Between -day precision . در این روش نیز نمونه مورد آزمایش در هر بار انجام آزمایش میبایست چهار بار تست شود (۷).
صحت (Accuracy)
صحت در اصل بیانگر مقدار واقعی یک آزمایش است و میزان نزدیک بودن میانگین آنالیتهای اندازهگیریشده را با مقدار واقعی آن مورد بررسی قرار میدهد. به اختلاف حاصل از این دو، عدم صحت یا سوگرایی یا Bias میگویند.
بررسی تداخلات (interference)
یکی از موارد مهم مؤثر بر روی صحت یک کیت، مسئله تداخلات است. تداخلات میتوانند هم باعث سوگرایی مثبت و یا نتایج مثبت کاذب و هم سوگرایی منفی و یا نتایج منفی کاذب در آزمایشها گردند. از عوامل مختلفی که باعث بروز تداخل میگردند میتوان به تأثیر هتروفیل آنتیبادی، فاکتور روماتوئیدی و اثر هوک اشاره کرد. آنتیبادیهای هتروفیل گروهی از آنتیبادیها هستند که در پی تماس مستقیم و یا غیرمستقیم با حیوانات در انسان ایجاد میشوند. این آنتیبادیها با چسبیدن به قسمتهای FC ملکولهای آنتیبادی میتوانند باعث سوگرایی مثبت و منفی در آزمایشها شوند. فاکتور روماتوئیدی از عوامل دیگر تداخلکننده محسوب میشود. جنس این فاکتور از جنس IgM بوده و علیه قسمت FC مولکولهای IgG است. این فاکتور را میتوان در بسیاری از بیماران مبتلا به بیماریهای خود ایمنی مشاهده نمود .(۸)
گاهی در آزمایشهای یک مرحلهای با فرمت ساندویچی که در نمونه مقدار بسیار زیادی آنالیت وجود داشته باشد میتوان جوابهای منفی مشاهده نمود که به این پدیده اثر هوک اطلاق میگردد. اثر هوک (hook effect)
عبارت از کسب نتایج منفی کاذب در غلظت بالای آنالیت است، در واکنشهای ایمونولوژی اتفاق افتاده و معادل پدیده پروزون در واکنشهای سرولوژی است. در این پدیده غلظت آنالیت که میتواند آنتیژن یا آنتیبادی باشد، از بالاترین استاندارد نیز بسیار بالاتر بوده و لذا علیرغم زیاد بودن آنتیژن یا آنتیبادی مورد آزمایش در سرم، نتیجه منفی کاذب حاصل میگردد.
بهدلیل نتایج منحرفکننده و نامطلوبی که اثر هوک میتواند بر آزمونهای ایمنی سنجی باقی گذارد، تحقیقات زیادی در زمینه شناخت این پدیده و چگونگی خنثیسازی آن انجام شده است که یکی از آنها با توجه به اینکه پدیده هوک در روش EIA بدلیل تکمرحلهای و مستقیم بودن روش آزمایش، شایعتر از روش IEMA است؛ عدم استفاده از اینچنین کیتهایی است. در شرایطی که ناچار به استفاده از چنین کیتهایی باشیم، برای اطمینان از صحت نتیجه، اول از کیتهایی استفاده شود که محدوده شروع پدیده هوک در آن قید شده باشد و ثانیاً بایستی هر جواب منفی را با رقتهای بالاتری از همان سرم تکرار نمود.
البته باید توجه داشت که اگرچه پدیده هوک غالباً در اثر فزونی آنالیت اتفاق میافتد، ولی تحقیقات انجامشده توسط محققان ثابت نموده که منحصراً بالا بودن میزان آنالیت تنها عاملی نیست که در بروز این پدیده دخالت داشته و لذا عوامل دیگری نیز نظیر توزیع و پراکندگی اپیتوپها، وجود اپیتوپهای مشابه و یا استفاده از دو آنتیبادی مونوکلونال که بر ضد دو اپیتوپ مختلف تهیه شدهاند، میتواند در بروز پدیده هوک مؤثر باشد که نمونه آن نیز ایجاد پدیده هوک در روشهای IEMA علیرغم دومرحلهای بودن آنها است که علت آن در نتیجه استفاده از دو آنتیبادی مونوکلونال بر ضد دو اپیتوپ مختلف است .(۹)
مکانیسم این اثر به این شکل است که در آزمایشهای ساندویچی یک مرحلهای، با افزودن نمونه و آنتیبادی نشاندارشده بهصورت همزمان بدلیل وجود مقدار بسیار زیاد آنالیت، هردو آنتیبادی (آنتیبادی نشاندار در محلول و آنتیبادی موجود در کف چاهکها) توسط مولکولهای آنالیت اشغال میگردند و امکان ایجاد پل رابط مابین آنتیبادی موجود در کف چاهک و آنتیبادی نشاندار در محلول از بین میرود. حاصل این مسئله مشاهده نتایج منفی کاذب در آزمایشها است و بهترین مثال عملی آن را نیز میتوان در خانمهای باردار دارای مقدار زیاد هورمون HCG دید.(۱۰)
در این گروه از افراد چنانچه آزمایشها بهصورت یک مرحلهای یعنی افزودن همزمان نمونه بیمار با کنژوگه صورت گیرد، احتمال مشاهده نتایج منفی کاذب وجود دارد. برای رفع این مشکل نیز میتوان با رقیق کردن نمونه مورد آزمایش و یا با دو مرحلهای کردن آزمایشها تأثیر اثر هوک را از بین برد.
حساسیت (SENSITIVY)
حساسیت بنا به تعریف به کمترین مقدار آنالیت که از صفر قابل تفکیک باشد اطلاق میگردد. حساسیت به دو گروه آنالیتی و عملکردی تقسیمبندی میشود.
حساسیت آنالیتی ( Analytical sensitivity)
در این نوع حساسیت که اکثر سازندگان کیتها از آن استفاده میکنند ۲۰ بار استاندارد صفر را مورد آزمایش قرار میدهند و ۲ انحراف استاندارد بالاتر (در تستهای ایمونومتریک) و یا پایینتر (در تستهای رقابتی) را محاسبه مینمایند .جهت مشاهده این نتیجه میبایست حتماً به بروشور کیت مراجعه نمایید و چنانچه حساسیت یک کیت بهطور مثال ۰٫۲ IU/ml ذکر گردیده بود، گزارشهای نتیجه کمتر از این حد خطا است.
حساسیت عملکردی (Functional sensitivity)
این نوع حساسیت منطبق بر میزان دقت در نمونههایی با مقادیر بسیار پایین است. در این روش با رقیق نمودن نمونه یا سرم دارای مقدار پایین آنالیت و رسم منحنی precision profile برای آن غلظتی که در آن میزان دقت، حداکثر به ضریب
(% Cv ۲۰ درصد) رسیده باشد، بهعنوان حساسیت تلقی میگردد. جهت تعیین این نوع حساسیت میبایست نمونه سرم با غلظت پایین آنالیت را انتخاب نمود و از آن رقتهای مختلف تهیه کرد و بر روی هر رقت چندین بار آزمایش انجام داد و ضریب تغییرات cv% را محاسبه نمود. کمترین مقداری از آنالیت که در آن ضریب تغییرات به کمتر از ۲۰ درصد رسیده باشد بهعنوان حساسیت عملکردی تلقی میگردد.
منابع ایجاد خطا در الایزا
۱- عدم رعایت روش ذکرشده در بروشور (کمپانی سازنده ممکن است بدون اطلاع قبلی روش کار خود را عوض کند).
۲- باز کردن فویل حاوی پلیت (بلافاصله بعد از آنکه از یخچال خارج شد): پلیت سرد، بخار آب موجود در هوا را به قطرات کوچکی تبدیل میکند که روی جدارهای چاهکها خواهد نشست. این عمل سبب میشود که در برخی تستها که حجم نمونه کم است (مثلاً ۱۰ میکرولیتر) نمونه رقیق شود. در هنگام باز کردن فویل حاوی پلیت به کپسول نمگیر موجود در آن دقت شود. اگر پوشش فوق سوراخ باشد کپسول نمگیر تغییر رنگ میدهد و یا سیلیکاژل موجود در آن به هم میچسبد.
۳- اثر همولیز بر روی نتایج: هموگلوبین به دلیل ماهیت پروتئینی، فعالیت پراکسیدازی داشته و همچنین به دلیل وجود آهن و هم میتواند سرعت واکنش پراکسید هیدروژن و کروموژن را تسریع کرده و بهطور کاذب باعث افزایش جذب نوری شود. از طرفی هموگلوبین واکنش آنتیژن و آنتیبادی را دستخوش تغییر میکند و زمان به تعادل رسیدن واکنش را افزایش میدهد (مثل Free T۴ که بهطور کاذب کاهش مییابد).
۴- تأثیر ضد انعقاد استفادهشده: ضد انعقاد EDTA بهعنوان شلاتهکننده یونهای فلزی میتواند روی (ZN) که بهعنوان کوفاکتور آنزیم آلکالین فسفاتاز است را مهار کند. فلوئور سدیم که بهعنوان نگهدارنده قند استفاده میشود میتواند فعالیت آنزیم اورهآز را مهار کند، بنابراین در سنجشهایی که از آنزیم اورهآز بهعنوان ماده نشانگر استفاده شده است، تداخل میکند .(۱۰)
سدیم آزاید بهعنوان یک مهارکننده قوی آنزیم پراکسیداز است و هرگز نباید در سنجشهایی که نشانگر آنزیمی آنها پراکسیداز است از نمونه حاوی سدیم آزاید استفاده شود (۹).
۵- پلیتها در هنگام رنگزایی باید در دمای ۲۵-۱۸ درجه سانتیگراد قرار گرفته و در معرض باد سرد و گرم نباشند چرا که دمای محیط میتواند سرعت واکنش رنگزایی را تغییر داده و در نتیجه منجر به رنگزایی کم یا زیاد شده و با بیاعتبار کردن کنترل مثبت و منفی کل کار انجام شده را بیاعتبار (invalid) کند .(۳)
۶- خطا در زمان انکوباسیون (خطای زمانی در انکوباسیونهای کوتاهمدت بیشتر است). در مرحله انکوباسیون و در اثر آنزیم به یک محصول رنگی – تبدیل میشود- بههیچوجه از فویل آلومینیومی برای پوشاندن سطح پلیت استفاده نشود.
مشکلات مرتبط به شستشو:
عمل شستشو جهت جدا کردن ترکیبات اتصالیافته به کف چاهک از ترکیباتی که متصل نشدهاند صورت میگیرد. غیر از ترکیبات محلول شستشو، نکات دیگری نیز باید مدنظر قرار گیرد.
فشار بالای شستشو در روش دستی ناشی از تخلیه سریع بافر است که منجر به جداسازی و حذف اتصالات اختصاصی از کف چاهکها و کاهش کاذب (OD) میگردد.
فشار پایین شستشو به علت تخلیه آهسته بافر در روشهای دستی منجر به عدم دفع کامل اتصالات غیراختصاصی و افزایش کاذب جذب نوری (OD) میگردد (۱۱).
مشکلات مربوط به شستشو بهسختی قابل تشخیص بوده و بهصورت اتفاقی با خواندههایی که خیلی بالا و یا پایین باشد مشخص میشوند. رفع این مشکل کالیبره کردن مجدد دستگاه شوینده است. محلول شستشو معمولاً غلیظتر بوده و باید در آزمایشگاه رقیق شود. اگر رقت درست صورت نگیرد و محلول غلیظتر از حد توصیهشده باشد، منجر به تخریب و جدا شدن مولکولهای اتصالیافته میشود و برعکس کاهش توانایی محلول شستشو بدلیل رقیقسازی زیاد باعث عدم جدا شدن اتصالات غیراختصاصی و ایجاد جذب زمینهای بالا میشود. مرحله شستشو حداقل باید سه بار انجام شود و محلول اضافی باید تخلیه شده و یا آسپیره گردد. در نهایت باید محلول اضافه داخل چاهک با کوبیدن بر سطح یک کاغذ یا دستمال نمگیر خالی شود (دستورالعمل کنترل کیفی آزمایشگاه رفرانس قم).
۷- Soak time: رعایت زمان خیس خوردن سبب میشود که اتصالات غیراختصاصی از چاهکها کنده شود. عدم رعایت این موضوع موجب ایجاد یک رنگ زمینه در کل چاهکهای پلیت کاری خواهد شد و اگر تست فاقد چاهک بلانک باشد این موضوع منجر به ایجاد جوابهای کاذب میشود. این زمان در بروشور کیت آمده است و بین ۳۰ ثانیه تا چند دقیقه متغیر است.
۸- لیپمی در سنجش آنالیتهایی که یک مولکول آبگریز است بدلیل آنکه توزیع آنالیت بین دو فاز آبگریز و آبدوست به دلیل وجود لیپید مختل میشود و همینطور در بعضی از آنالیتها که به پروتئین حامل متصل میشود وجود اسید چرب آزاد ممکن است در اتصال آنالیت به پروتئین حامل تداخل نماید و سبب افزایش کاذب میزان آنالیت آزاد میشود (بهخصوص هورمونهای تیروئیدی و استروئیدی)، بنابراین ناشتا بودن در این آزمایشها ضروری است.
۹- تماس دﺳﺖ ﺑﺎ ﻧﻮک ﺳﻤﭙﻠﺮ و آلودگی ﺑﺎﮐﺘﺮﯾﺎل آن میتواند ﻣﻨﺠﺮ ﺑﻪ آلودگی ﻣﺤﻠﻮل کنژوگه و ﺗﻀﻌﯿﻒ ﯾﺎ ﺧﻨﺜﯽ ﺷﺪن ﻣﻌﺮف کنژوگه ﮔﺮدد. اﺳﺘﺎفیلوکوکها و اﺳﺘﺮﭘﺘﻮﮐﻮکها بهواسطه رﺳﭙﺘﻮر FC ﻗﺎدر ﺑﻪ ﺟﺬب غیراختصاصی اﯾﻤﻮﻧﻮﮔﻠﻮﺑﯿﻦ G در ﻣﺤﯿﻂ ﺑﻮده و ﻣﻨﺠﺮ ﺑﻪ ﺟﺬب آﻧﺘﯽﺑﺎدی کنژوگه و ﺗﻀﻌﯿﻒ ﺗﯿﺘﺮ کنژوگه میگردند.
۱۰-EDGE EFFECT یا اثر حاشیهای: انکوباتور ۳۷ درجه سانتیگراد بهواسطه شوک حرارتی و اختلاف حرارت محیط کار و محیط داخلی انکوباتور حاصل میگردد و عمدتاً در سطح استریپهایی که مجاور درب خارجی انکوباتور قرار دارند ایجاد میشود و جذب نوری (OD) غیریکنواخت خصوصاً در استریپهای ابتدایی حاصل میشود. این امر بهواسطه ورود ناگهانی سرمای محیط به داخل انکوباتور است، لذا از انکوباسیون پلیتهای الایزا در مکانهایی که شرایط محیطی متغیر دارند، پرهیز گردد
فراپژوهش