توزیع آهن بدن
آهن از نظر مقدار، مهمترین میکرومینرال محسوب میگردد. رژیم غذایی روزانه تقریباً حاوی ۲۰- ۱۰ میلیگرم آهن بوده که در حدود ۱۰% آن (یعنی تقریباً ۲- ۱ میلیگرم) جذب بدن میشود. میزان جذب آهن بدن متناسب با مقدار از دست دادن آهن بدن میباشد. ملکولهای آهن در خون به کمک ترانسفرین، منتقل میشوند. بدن انسان حاوی ۵- ۴ گرم آهن بوده که عمدتاً به فرم متصل شده به پروتئین میباشد. تقریباً سه چهارم کل این مقدار در پروتئینهای هم (Heme) (عمدتاً هموگلوبین و میوگلوبین) یافت میشود.
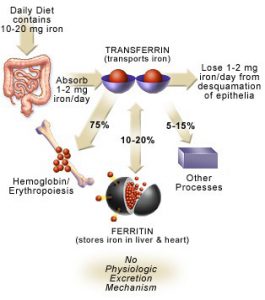
تقریباً ۱% آهن بدن نیز به شکل خوشههای آهن- سولفور (Iron-Sulfur clusters) میباشد که به عنوان کوفاکتور در زنجیره تنفسی نقش دارد. بقیه آهن بدن نیز به فرم انتقالی در جریان گردش خون و یا به فرمهای پروتئینی ذخیرهای موجود میباشد.
متابولیسم آهن
در رودهها تنها فرم دو ظرفیتی آهن (Fe۲+) که قادر به عبور از غشاء پلاسمایی میباشد، جذب میگردد، بنابراین با توجه به این که عمده آهن رژیم غذایی به فرم سه ظرفیتی موجود است، عوامل احیا کننده از قبیل ویتامین C به افزایش برداشت آهن کمک مینمایند. آهن دو ظرفیتی در رودهها از طریق ترانسپورترهای سمت لومینال (Luminal) و بازال (Basal) سلولهای اپیتلیال روده و یا از آهن ذخیره شده در کبد، وارد گردش خون شده و در داخل خون به ملکول ترانسفرین متصل میشود. در داخل خون، آهن دو ظرفیتی مجدداً توسط فرواکسیداز II به آهن سه ظرفیتی تبدیل میشود. مقداری از آهن جذب شده ممکن است به فرم فریتین و یا هموسیدرین در بدن ذخیره شود.
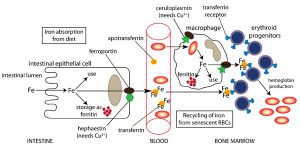
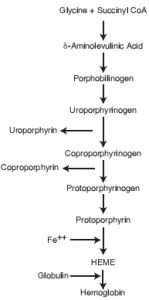
قسمت اعظم آهن جذب شده برای تشکیل گلبولهای قرمز در مغز استخوان مورد استفاده قرار میگیرد. همان طوری که در تصویر زیر نیز مشاهده میشود تنها در مرحله انتهایی سنتز هم (Heme) است که آهن دو ظرفیتی به کمک آنزیم فروشلاتاز وارد حلقه تتراپیرولی سنتز شده میگردد.
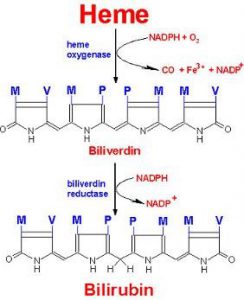
در داخل جریان خون، ۳- ۲/۵ گرم از آهن هموگلوبین به عنوان جزئی از گلبولهای قرمز، در گردش میباشد. پس از مدتی انعطاف پذیری گلبولهای قرمز رو به کاهش گذاشته که این امر موجب آسیب غشاء گلبولهای قرمز میگردد. این گلبولهای قرمز فرسوده توسط ماکروفاژهای کبد و سایر بافتها برداشته شده و تجزیه میشوند.
بخش آلی هم (Heme) به بیلیروبین اکسیده شده، در حالی که آهن آن مجدداً به پلاسما برمیگردد. میزان آهن ناشی از بازگردش روزانه هم (Heme) به مراتب بیش از میزان جذب شده آن توسط رودهها میباشد.
انتقال آهن
ترانسفرین، یک بتا-گلبولین منفرد (مونومر) با وزن ملکولی ۸۰۰۰۰ دالتون بوده که وظیفه آن جابجایی آهن در داخل خون میباشد. پروتئین ترانسفرین شامل دو ناحیه (Domain) مشابه بوده که هر کدام از آنها میتواند به طور محکم به آهن سه ظرفیتی متصل شود. در حدود یک نهم ملکولهای ترانسفرین دارای آهن در هر دو ناحیه خود، چهار نهم آنها دارای آهن متصل شده در یکی از نواحی خود و چهار نهم بقیه ترانسفرینها نیز فاقد هر گونه آهن متصل شده هستند. این بدان معنی است که در حالت طبیعی، تنها در حدود یک سوم ترانسفرینها از آهن اشباع شدهاند.
پروتئینهای جابجا کننده آهن مشابهی در ترشحات مختلف بدن از قبیل بزاق، اشک و شیر نیز یافت شدهاند که تحت عنوان لاکتوفرینها (Lactoferrins) نامیده میشوند. ترانسفرین و لاکتوفرینها، غلظت آهن آزاد مایعات بدن را در محدوده زیر ۱۰-۱۰ مول در لیتر نگه میدارند. این سطح پایین آهن آزاد از رشد باکتریها که نیازمند آهن آزاد برای رشد خود میباشند، جلوگیری میکند.
ذخیره آهن بدن
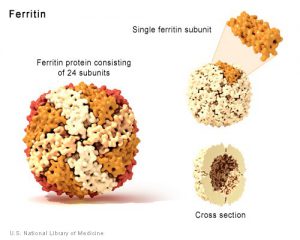
آهن اضافی به فرم فریتین در کبد و سایر بافتها ذخیره میشود. ملکول فریتین خود متشکل از ۲۴ زیر واحد بوده که به شکل کرههای توخالی میباشند. مولکولهای فریتین پس از اکسیده کردن آهن دو ظرفیتی اضافی و تبدیل آن به آهن سه ظرفیتی، آن را در قسمت داخل ملکول کروی خود به فرم Ferrihydrate ذخیره مینمایند. هر ملکول فریتین قادر به ذخیره چند هزار یون آهن از این طریق میباشد. علاوه بر فرم ذخیرهای فریتین، یک فرم ذخیرهای دیگر از آهن موسوم به هموسیدرین (Hemosiderin) نیز وجود دارد که عملکرد آن به خوبی درک نشده است.
اختلالات ناشی از تغییرات میزان آهن
اختلالات ناشی از متابولیسم آهن در بدن متعدد بوده که میتوانند در برخی موارد منجر به بیماریهای جدی شوند. فقر آهن معمولاً در نتیجه از دست رفتن خون و یا دریافت ناکافی آهن رخ میدهد. در طی حاملگی، افزایش نیاز به آهن میتواند منجر به فقر آهن شود. در این بیماران، گلبولهای قرمز کوچکتر از اندازه طبیعی (میکروسیت) بوده و دارای محتوای آهن کمتری میباشند.
شیوع فقر آهن در کودکان، مردان، زنان قبل از سن یائسگی و زنان حامله به ترتیب در حدود ۹، ۲، ۱۱ و ۵۰% میباشد. علت این امر در کودکان، کاهش آهن رژیم غذایی به دلیل محتوای آهن بسیار کم شیر و در بزرگسالان نیز معمولاً از دست دادن خون به صورت مزمن میباشد. علائم شایع کمخونی شامل خستگی (Tiredness)، کوفتگی مزمن (Chronic fatigue)، سرگیجه (Dizziness)، ضعف (Weakness) و سردرد (Headaches) میباشد.
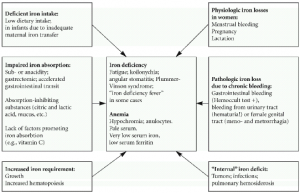
اختلالات ناشی از افزایش آهن موسوم به هموکروماتوزیس، شیوع کمتری دارند. این اختلالات میتوانند منشأ ژنتیکی داشته و یا در نتیجه تجویز مکرر خون رخ دهند. شیوع افزایش آهن بدن در ایالات متحده در حدود ۱% میباشد. از آن جایی که بدن فاقد مکانیسمی برای دفع آهن است، در صورت عدم درمان، آهن اضافی با گذشت زمان در ارگانهای مختلف بدن انباشته شده که میتواند منجر به اختلالات جدی در عملکرد این ارگانها گردد. از علائم شایع ناشی از تجمع آهن در بدن به درد مفاصل (Joint pain)، کوفتگی (Fatigue)، ضعف (Weakness)، فقدان انرژی (Lack of energy)، درد شـــــــــــــــــکم (Abdominal pain)، کاهش قدرت جنسی (Loss of sexdrive) و مشکلات قلبی (Heart problems) میتوان اشاره نمود.
به طور کلی، شرایط اصلی افزایش آهن بدن در سه دسته جای میگیرند:
- هموسیدروزیس (Hemosiderosis): در این حالت، افزایش آهن بدن بدون حضور آسیب بافتی رخ میدهد.
- هموکروماتوزیس (Hemochromatosis): در این حالت، افزایش آهن بدن به همراه آسیب بافتی وجود دارد. این وضعیت غالباً ناشی از افزایش مزمن جذب آهن رخ میدهد.
- هموکروماتوزیس ارثی (Hereditary hemochromatosis): این حالت، یک اختلال کلاسیک افزایش آهن میباشد. شیوع فرم هموزیگوت این اختلال در حدود ۵ در ۱۰۰۰ است.
در هر سه وضعیت فوق، سطح سرمی آهن، اشباع ترانسفرین و فریتین بالا است. معمولاً ترانسفرین و TIBC در هموکروماتوز پایین میباشند.
بررسی آزمایشگاهی وضعیت آهن سرم در اختلالات مختلف
یکی از متداولترین بیماریهایی که در آزمایشگاه با آن مواجه میشویم فقر آهن است که آن نیز به نوبه خود میتواند منجر به آنمی (کمخونی) گردد. آنمی فقر آهن در خانمها به علت عادتهای ماهیانه شایع بوده، در حالی که این امر در آقایان باید به طور جدی پیگیری و ریشهیابی شود. سؤالی که مطرح میشود این است که در بررسی فقر آهن انجام چه آزمایشاتی ضروری است و آیا میتوان به اندازهگیری میزان آهن سرم، TIBC، فریتین، هموگلوبین، MCV و … بسنده نمود و یا آزمایشات بیشتری لازم است. برای پاسخ به این سؤال ابتدا مراحل ایجاد آنمی فقر آهن را در ارتباط با تغییرات آزمایشگاهی در جدول ذیل بررسی میکنیم.
| مراحل مختلف | فریتین | TIBC | آهن | هموگلوبین |
| مرحله ۱ | کاهش | طبیعی | طبیعی | طبیعی |
| مرحله ۲ | کاهش | افزایش | طبیعی | طبیعی |
| مرحله ۳ | کاهش | افزایش | کاهش | طبیعی |
| مرحله ۴ | کاهش | افزایش | کاهش | کاهش |
باید توجه داشت که در کاهش هموگلوبین ابتدا گلبولها به صورت نروموکروم (غلظت طبیعی هموگلوبین درون سلولی) و نروموسیت (اندازه طبیعی سلول) بوده و به تدریج به فرم هیپوکروم (غلظت کاهش یافته هموگلوبین درون سلولی) و میکروسیت (اندازه سلولی کوچکتر از حد طبیعی) در میآیند. نوسانات روزانه آهن سرم خیلی زیاد بوده و بین ۳۰ تا ۱۰۰ درصد گزارش شده است. از آن جایی که سطح آهن سرم در شرایطی از قبیل التهابات، تولید گلبولهای قرمز (اریتروپویز) و مصرف آهن خوراکی، تحت تأثیر قرار میگیرد، اکتفا به یک نتیجه منفرد آهن سرم، معقول به نظر نمیرسد. افزایش RDW (Red Blood Cell Distribution Width) (پهنای توزیع گلبولهای قرمز) نیز از نخستین نشانههای هماتولوژیک فقر آهن بشمار میرود.
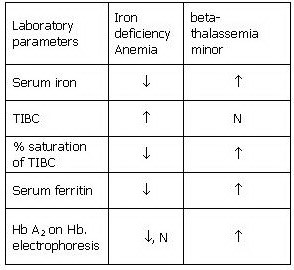
برای تخمین وضعیت آهن در بدن، اندازهگیری ترانسفرین و فریتین میتواند جزئیات بیشتری را مشخص نماید. برای ارزیابی و افتراق آنمی فقر آهن از تالاسمی مینور، از پارامترهای مختلفی میتوان بهره گرفت. این پارامترها میتوانند شامل تعداد گلبولهای قرمز، میزان MCV، MCH، Hb A۲، RDW و تغییرات مرفولوژی گلبولهای قرمز علاوه بر آزمایشهای آهن، فریتین، TIBC و درصد اشباع ترانسفرین باشند. تغییرات این پارامترها در آنمی فقر آهن و تالاسمی مینور در جدول ذیل آمده است.
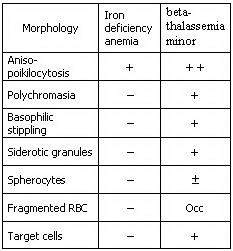
به طور کلی، (مثلاً در مورد آزمایشات ازدواجی) افرادی که دارای MCV و MCH به ترتیب کمتر از ۸۰ و ۲۷ میباشند، ابتدا باید به منظور اطمینان از عدم کاهش سطح آهن بدن، به مدت یکماه فرآوردههای آهن را مصرف نموده و پس از آن مجدداً آزمایش CBC آنها چک شود، زیرا در صورت وجود همزمان آنمی فقر آهن و تالاسمی مینور در یک فرد، این دو اختلال با همدیگر همپوشانی نموده و نتیجه آزمایشات را تحت تأثیر قرار میدهند. برای مشاهده تغییرات مرفولوژیک گلبولهای قرمز متعاقب مصرف آهن حداقل ۲ هفته زمان لازم است.
در صورت عدم مرتفع شدن کاهش سطح MCV و MCH پس از مصرف آهن، آزمایشات آهن، فریتین، TIBC و سطح هموگلوبین A۲ انجام میشود. سطح هموگلوبین A۲ در بتا تالاسمی مینور بیشتر از ۵/۳% و در آنمی فقر آهن، کمتر از ۵/۳% میباشد. در آنمی فقر آهن، تعداد گلبولهای قرمز کاهش یافته، در حالی که در بتا تالاسمی مینور تعداد گلبولهای قرمز افزایش مییابد. MCH کمتر از ۲۰ به طور قوی نشان دهنده تالاسمی مینور است. از فرمول زیر میتوان برای ارزیابی اولیه افتراق آنمی فقر آهن از تالاسمی مینور استفاده نمود.
MCV-RBC-(۵×Hb)-۳,۱۴
چنانچه نتیجه این فرمول، صفر و یا یک عدد مثبت شد، فقر آهن و چنانچه یک عدد منفی حاصل شد، تشخیص تالاسمی مینور مطرح میگردد. کارآیی این فرمول را بیش از ۹۹% برآورد نمودهاند.
نمونهگیری
نمونه مورد نیاز شامل سرم و یا پلاسمای هپارینه میباشد. نمونه مورد نیاز برای آزمایش آهن باید فاقد همولیز بوده و به این منظور لازم است که سرم و یا پلاسما در طی حداکثر ۲ ساعت پس از نمونهگیری جدا شود. پایداری آهن سرم و یا پلاسمای هپارینه در دمای ۱۵ تا ۲۵ درجه سانتیگراد به مدت ۴ روز و در دمای ۲ تا ۸ درجه سانتیگراد به مدت ۷ روز میباشد. آزمایش آهن حساس بوده و باید از آلوده شدن نمونهها خودداری شود. با توجه به تغییرات روزانه آهن بدن، نمونه ناشتا توصیه میگردد.
روشهای اندازهگیری آهن
آزمایش آهن به روش فتومتریک و با استفاده از ترکیبات مختلفی از قبیل Ferene، Bathophenanthroline، Complexing chromogen،کولومتری الکتروشیمی (Electrochemical coulometery) و اسپکتروسکوپی جذب اتمی (atomic absorption spectroscopy) انجام میشود.
اصول اندازهگیری آهن
در تمامی روشهای فتومتریک اندازهگیری آهن، ابتدا آهن سه ظرفیتی متصل به ترانسفرین در یک محیط اسیدی از ترانسفرین جدا شده و سپس آهن سه ظرفیتی، تحت تأثیر عوامل احیا کننده به آهن دو ظرفیتی تبدیل میشود. در مرحله بعد، آهن دو ظرفیتی در اثر ترکیب با یک ماده شیمیایی (Ferene، Bathophenanthroline، Complexing chromogen و …)، یک کمپلکس رنگی ایجاد نموده که با اندازهگیری آن به غلظت آهن پی برده میشود. لازم به یادآوری است که در روشهای Ferene و Complexing chromogen، میزان آهن متناسب با شدت رنگ بوده؛ در حالی که در روش Bathophenanthroline، میزان آهن با شدت رنگ حاصله، رابطه عکس دارد.
افزایش آهن سرم و یا پلاسما
افزایش مقادیر آهن در هموکروماتوزیس، هموسیدروزیس و مسمومیت حاد آهن (به ویژه در مورد کودکان که ممکن است بیش از دوز توصیه شده از ویتامینها و یا سایر مکملهای حاوی آهن مصرف نمایند) دیده میشود. مصرف ضد بارداریهای خوراکی (به دلیل افزایش سنتز ترانسفرین) موجب افزایش آهن سرم میگردند. مصرف داروهای حاوی آهن به ویژه به صورت تزریقی موجب افزایش آهن سرم میگردند. مثلاً دریافت ۳۰۰ میلیگرم از سولفات فرو (FeSO۴) موجب افزایش آهن سرم به میزان ۵۰۰- ۳۰۰ میکروگرم در دسیلیتر میگردد.
مصرف فرآوردههای حاوی آهن در بیمارانی که دارای فقر آهن هستند، یک اثر همپوشانی ایجاد مینماید. پیک غلظت آهن سرم در طی چند ساعت پس از مصرف فرآوردههای حاوی آهن مشاهده میشود. این مسئله به دلیل احتمال همپوشانی برای تشخیص کمبود آهن به ویژه در افرادی که دارای فقر آهن میباشند حائز اهمیت است. در روند هپاتیت و آسیبهای کبدی نیز به دلیل رها شدن ذخایر آهن کبد، آهن سرم افزایش مییابد. اختلالاتی که با افزایش آهن سرم و یا پلاسما همراه هستند در جدول زیر آورده شدهاند.
| Disorders | |
| HFE-associated hemochromatosis (Type ۱ hemochromatosis) | Hemochromatosis disorders |
| Juvenile hemochromatosis (Type ۲ hemochromatosis) | |
| TFR۲- associated hemochromatosis (Type ۳ hemochromatosis) | |
| Type ۵ hemochromatosis | |
| Autosomal dominant siderosis (Type ۴ hemochromatosis) | Siderosis disorders |
| African siderosis | |
| Atransferrinemia | Disorders of iron balance |
| Aceruloplasminemia | |
کاهش آهن سرم و یا پلاسما
کاهش آهن در آنمی فقر آهن، بیماریهای التهابی، هموراژی، اهداء خون و خونریزیهای شدید در دوران قاعدگی رخ میدهد. در مراحل اولیه درمان برخی آنمیها نیز میزان آهن سرم کاهش مییابد، مثلاً در درمان آنمی پرنیسیوز با ویتامین کوبالامین (B۱۲)، به دلیل افزایش سنتز هموگلوبین و برداشت آهن از سرم و ذخایر آهن بدن، میزان آهن کاهش مییابد.
مقادیر نرمال و گروههای مختلف سنی در جدول زیر آمده است.
| گروه | محدوده سنی | مقادیر نرمال آهن |
| مقدار طبیعی آهن برای هر دو جنس کودکـــان | نوزاد ۱ تا ۱۴ روزه | μg/dl ۲۰۱- ۶۳ |
| نوزاد ۱۵ روزه تا ۶ ماهه | μg/dl ۱۳۵- ۲۸ | |
| نوزاد ۶ ماهه تا ۱ ساله | μg/dl ۱۵۵- ۳۵ | |
| کودک ۲ ساله تا ۱۲ ساله | μg/dl ۱۳۵- ۲۲ | |
| زنان | تا ۲۵ سال | μg/dl ۱۶۵- ۳۷ |
| تا ۴۰ سال | μg/dl ۱۳۴- ۲۳ | |
| تا ۶۰ سال | μg/dl ۱۴۹- ۳۹ | |
| زنان باردار | ۱۲ هفته ابتدای بارداری | μg/dl ۱۷۷- ۴۲ |
| اواخر دوره بارداری | μg/dl ۱۳۷- ۲۵ | |
| تا ۶ هفته پس از زایمان | μg/dl ۱۵۰- ۱۶ | |
| مردان | تا ۲۵ سال | μg/dl ۱۵۵- ۴۰ |
| تا ۴۰ سال | μg/dl ۱۶۸- ۳۵ | |
| تا ۶۰ سال | μg/dl ۱۲۰- ۴۰ |
فریتین (Ferritin)
مطالعه فریتین سرم به عنوان یک اندیکاتور خوب بررسی وضعیت آهن بدن بکار میرود. سطح سرمی فریتین که بیشترین پروتئین ذخیرهای آهن بدن را نیز شامل میگردد، متناسب با میزان آهن ذخیره بدن میباشد. سطح فریتین بسیار پایین بوده (در حدود ۱% کل آهن سرم) و در تعادل با ذخایر آهن بدن میباشد. در افراد طبیعی هر ۱ نانوگرم در میلیلیتر (ng/ml) از فریتین سرم تقریباً معادل ۸ میلیگرم آهن ذخیره شده میباشد. در فریتین، آهن به صورت میسلهای کمپلکسهای هیدراته اکسید فریک- فسفات که به سطح داخلی آن متصل شدهاند، وجود دارد.
فریتین به عنوان یک اندیکاتور بسیار حساس برای وضعیت آهن بدن به ویژه برای فقر آهن بجز در اختلالات التهابی مزمن از قبیل آرتریت روماتوئید، بیماریهای کلیوی و بدخیمیها بویژه لنفوما، لوکمی، سرطان سینه و نوروبلاستوما به کار میرود. کاهش سطح فریتین سرم دلالت بر کاهش ذخیره آهن بدن دارد. سطح فریتین سرم کمتر از ۱۲ نانوگرم در دسیلیتر به عنوان معیار تشخیصی آنمی فقر آهن در نظر گرفته میشود. کاهش سطح فریتین سرم در آنمی فقر آهن، مقدم بر سایر پارامترها از قبیل کاهش سطح آهن سرم، تغییرات MCV، MCH و تعداد گلبولهای قرمز رخ میدهد.
محدودیت بزرگ اندازهگیری سطح فریتین سرم از آنجا ناشی میشود که فریتین به عنوان یک پروتئین فاز حاد (Acute phase protein) بوده و بنابراین میتواند افزایش آن ناشی از شرایطی غیر از وضعیت ذخایر آهن بدن از قبیل بیماریهای التهابی حاد، عفونتها، سرطانهای متاستاتیک، لنفوماها و … باشد.
پایین بودن فریتین دلیل برکمبود ذخایر میباشد، اما بالا بودن آن فقر آهن را رد نمیکند؛ زیرا فریتین جزء پروتئینهای فاز حاد بوده و در طی عفونتها و التهابات افزایش مییابد. افزایش سطح فریتین سرم، ۱ تا ۲ روز پس از بیماری حاد رخ داده و در طی ۳ تا ۵ روز نیز به بیشترین مقدار خود میرسد. سطح آهن سرم در ترکیب با سطح آهن سرم و TIBC میتواند ابزار مهمی در افتراق و طبقه بندی آنمیهای مختلف به شمار رود.
نمونه مورد نیاز
سرم و یا پلاسمای هپارینه مورد نیاز میباشد. نمونه باید عاری از همولیز باشد. مصرف ترکیبات حاوی آهن میتواند میزان فریتین را تحت تأثیر قرار دهد. بهتر است که خانمها در صورت نیاز به انجام این آزمایش در طی دوره قاعدگی انجام آن را موکول به زمان پس از قاعدگی نمایند.
افزایش فریتین خون
سطح فریتین سرم با افزایش سن در مردان و زنان پس از سن یائسگی افزایش مییابد. افزایش سطح فریتین سرم به عنوان نشانه افزایش میزان آهن به دلیل هموکروماتوزیس، هموسیدروزیس، مسمومیت با آهن، آنمی مگالوبلاستیک، آنمی همولیتیک، هپاتیت مزمن، تجویز اخیر خون و بیماریهای مزمن (از قبیل نئوپلاسم، الکلیسم، اورمیا، بیماریهای کلاژن و بیماریهای مزمن کبدی) میتواند باشد. داروهای حاوی ترکیبات آهن میتوانند منجر به افزایش سطح فریتین سرم گردند. همچنین سطح بالای فریتین سرمی در هپاتیتهای ویروسی مشاهده میشود.
کاهش فریتین خون
کاهش سطح فریتین سرم در طی آنمی فقر آهن مشاهده میشود. در موارد کاهش شدید پروتئینهای سرم از قبیل سوء تغذیه و در طی حاملگی نیز سطح فریتین سرم کاهش مییابد. اندازهگیری فریتین سرم همچنین در بیماران با نارسایی مزمن کلیوی به منظور ارزیابی وضعیت آهن بدن بکار میرود. بیماران همودیالیزی، دارای سطح پایینتری از فریتین میباشند. سطح فریتین سرم خانمها در طی دوره قاعدگی ممکن است کاهش یابد.
مقادیر نرمال
| جنسیت و گروه سنی | مقادیر نرمال | |
| بزرگسالان | مرد | ng/ml (μg/L) ۳۰۰- ۱۲ |
| زن | ng/ml (μg/L) ۱۵۰- ۱۰ | |
| کودکان | تازه متولد شده | ng/ml (μg/L) ۲۰۰- ۲۵ |
| ۱ ماهه | ng/ml (μg/L) ۶۰۰- ۲۰۰ | |
| ۲ تا ۵ ماه | ng/ml (μg/L) ۲۰۰- ۵۰ | |
| ۶ ماهه تا ۱۵ سال | ng/ml (μg/L) ۱۴۲- ۷ |
ظرفیت آهن ترانسفرین (TIBC) Total iron binding capacity
مقدمه
آهن در سرم به گلبولینی به نام ترانسفرین متصل میشود. معمولاً ترانسفرین از آهن اشباع نبوده؛ به طوری که در افراد سالم مقدار آهن متصل شده به ترانسفرین در حدود یک سوم حداکثر توانایی ترانسفرین در انتقال آهن است. مقدار اضافه آهنی که این پروتئین میتواند جذب کند تا کاملاً اشباع شود به نام ظرفیت آهن اشباع نشده (UIBC) (Unsaturated Iron Binding Capacity) نامیده میشود. به عبارتی دیگر، UIBC و یا آپوترانسفرین، قسمتی از ترانسفرین است که از آهن، اشباع نشده است. آزمایش TIBC به اندازهگیری بیشترین مقداری از آهن که میتواند به پروتئینهای سرم، به ویژه ترانسفرین متصل شده و در داخل خون ذخیره گردد، گفته میشود.

بنابراین TIBC در حقیقت اندازهگیری غیر مستقیم ترانسفرین میباشد. لازم به ذکر است که فریتین جزء پروتئینهای TIBC محسوب نمیشود، زیرا فریتین به فرم ذخیرهای آهن متصل است. TIBC در ۷۰% بیماران دچار فقر آهن افزایش مییابد. سطح سرمی پایین آهن به همراه افزایش TIBC، در تشخیص فقر آهن بسیار کمک کننده و مفید است. در شرایطی که نیاز به آهن افزایش مییابد (مانند فقر آهن و یا اواخر حاملگی)، TIBC افزایش یافته، در حالی که درصد اشباع ترانسفرین کاهش مییابد.
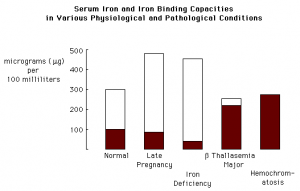
TIBC با میزان دریافت آهن، تغییرات کوچکی را خواهد داشت و حال آن که بیشتر منعکس کننده عملکرد کبد (به خاطر تولید ترانسفرین در کبد) و میزان تغذیه در مقایسه با متابولیسم آهن میباشد. همچنین مقادیر ترانسفرین برای مانیتور کردن بیمارانی که یک دوره دریافت تغذیه زیاد (Hyperalimentation) دارند به کار میرود. به طور کلی آزمایش TIBC در مواردی که میزان آهن سرم بسیار پایین و یا بالا میباشد درخواست میشود.
نسبت آهن سرم به TIBC را اشباع ترانسفرین و چنانچه این میزان در عدد ۱۰۰ ضرب شود، درصد اشباع ترانسفرین (TS%) (Transferrin saturation%) مینامند.
![]()
کاهش درصد اشباع ترانسفرین به کمتر از ۱۶% نشان دهنده فقر آهن است. در بچهها این نسبت کمتر بوده و تا ۷% هم میرسد. در بیماران دچار آنمیهای همولیتیک، سیدروبلاستیک و یا مگالوبلاستیک، بیماران دارای افزایش آهن و یا مسمومیت با آهن، اشباع ترانسفرین افزایش مییابد. در بیماران مبتلا به هموکروماتوزیس، ترانسفرین و TIBC، بسیار پایین بوده اما درصد اشباع ترانسفرین بسیاربالاست؛ به نحوی که در این بیماران درصد اشباع ترانسفرین به بیش از ۸۰- ۷۰% (و حتی گاهی تا ۱۰۰%) نیز میرسد. درصد اشباع ترانسفرین نیز با تأثیر از آهن، نوسان روزانه زیادی داشته و اختصاصی نیست. کاهش همزمان آن با فریتین به عنوان فقر آهن قابل تفسیر است.
نمونهگیری
نمونه مورد نیاز شامل سرم و یا پلاسمای هپارینه میباشد. نمونه مورد نیاز برای آزمایش آهن باید فاقد همولیز بوده و به این منظور لازم است که سرم و یا پلاسما در طی حداکثر ۲ ساعت پس از نمونهگیری جدا شود. آزمایش TIBC، حساس بوده و باید از آلوده شدن نمونهها خودداری شود. کلیه ظرفهای آزمایشگاهی مورد نیاز نیز از قبیل لولههای آزمایش، کووتها و … را باید ابتدا با اسید کلریدریک ۱ نرمال و سپس با آب مقطر کاملاً عاری از آهن شستشو داد و سپس استفاده نمود. نمونه سرم و یا پلاسمای مورد نیاز نیز نباید فریز شده باشد. با توجه به تغییرات روزانه آهن بدن، نمونه ناشتا توصیه میگردد.
روشهای اندازهگیری TIBC
اندازهگیری TIBC سرم و یا پلاسما معمولاً با روش Magnesium Carbonate Precipitating انجام میشود.
اصول اندازهگیری TIBC
تعیین TIBC در حقیقت اندازهگیری غیر مستقیم غلظت ترانسفرین خون است. به این منظور یون آهن (به فرم فریک آمونیوم سیترات و یا فریک کلراید) به سرم و یا پلاسمای مورد آزمایش افزوده شده تا تمام جایگاههای موجود در ترانسفرین از آهن اشباع شود. سپس آهن اضافی به کمک رزینهای تعویض یونی و یا با شلاته کردن توسط کربنات منیزیوم (MgCO۳) از محیط عمل خارج گردیده و پس از سانتریفوژ کردن و دکانته کردن (Decanted) مایع رویی که حاوی ترانسفرین اشباع شده میباشد، کل آهن متصل شده به ترانسفرین (با کمک روش اندازهگیری آهن) اندازهگیری میگردد.
افزایش TIBC سرم و یا پلاسما
آنمی فقر آهن، پلی سیتمی ورا، حاملگی (به ویژه اواخر حاملگی)، مصرف ضد بارداریهای خوراکی و استروژن درمانی با افزایش سطح ترانسفرین همراه هستند.
کاهش TIBCسرم و یا پلاسما
ترانسفرین، یک «پروتئین واکنشگر فاز حاد منفی» بوده و در واکنشهای التهابی حاد متعددی، سطح آن کاهش مییابد. همچنین در بیماریهای مزمنی از قبیل بدخیمیها، بیماریهای عروقی کلاژن، بیماریهای کبدی و اختلالات التهابی مزمن (به دلیل کاهش سنتز ترانسفرین)، سطح ترانسفرین کاهش مییابد. در هموکروماتوزیس، بیماریهای کبدی، سندروم نفروتیک و بیماریهای کلیوی که در آنها از دست رفتن پروتئین از طریق ادرار رخ میدهد نیز کاهش سطح TIBC را شاهد هستیم. هیپوپروتئینمی (کاهش سطح پروتئینهای خون) نیز با کاهش سطح ترانسفرین در ارتباط است. برای بررسی سوء تغذیه ممکن است که به موازات درخواست پره- آلبومین (Prealbumin)، اندازهگیری TIBC نیز درخواست شود.
تغییرات پارامترهای آهن، TIBC و فریتین در برخی اختلالات در جدول زیر آمده است.

مقادیر نرمال
مقادیر نرمال TIBC در افراد سالم μg/dl ۴۴۰- ۲۳۰ میباشد.
مقادیر نرمال درصد اشباع ترانسفرین برای مردان ۵۰- ۲۰% و برای زنان ۵۰- ۱۵% است.
پروتوپورفیرینهای آزاد گلبولهای قرمز (FEP)
(Free Erythrocyte Protoporphyrins)
این آزمایش، یک تست غربالگری به منظور تشخیص فقر آهن و مسمومیت با سرب، به ویژه در کودکان میباشد. در هر دو شرایط فوق، آخرین مرحله سنتز هم (Heme) به ترتیب در اثر عدم وجود آهن و اثر مهاری سرب متوقف میشود، بنابراین، پیشسازهای هم (Heme)، به ویژه پروتوپورفیرین IX تجمع مییابند. افزایش FEP همچنین در موارد نادر اریتروپوئتیک پورفیریا (Erythropoietic porphyria) و اریتروپوئتیک پروتوپورفیریا (Erythropoietic protoporphyria) دیده میشود. اختلالات تالاسمیک دارای سطح طبیعی از FEP میباشند.
رنگ آمیزی سیتوشیمی (Cytochemical staining)
رنگ آمیزی Cytochemical هموسیدرین در آسپیرههای مغز استخوان به وسیله واکنش Prussian blue، قطعیترین آزمایش برای بررسی وضعیت آهن میباشد. این آزمایش به عنوان استاندارد طلایی (Gold standard) پذیرفته شده است.
تعیین مقدار آهن کبد (Quantitative iron in liver)
اندازهگیری آهن در نمونه بیوپسی کبد در تشخیص هموکروماتوزیس به ویژه در مواردی که سطح سرمی آهن و TIBC در حد مرز (Borderline) باشد، بسیار کمک کننده است. تهاجمی بودن این روش، بزرگترین عیب آن به شمار رفته و انجام آزمایش را مشکل میسازد. مقادیر نرمال آهن در بیوپسی کبد، ۳۰۰- ۱۰۰ میکروگرم در هر گرم از بافت مرطوب (Wet tissue) میباشد.
Serum Transferrin Receptor assay (sTfR) (TfR)
تستهای آزمایشگاهی بررسی وضعیت آهن بدن شامل آهن سرم، TIBC و فریتین سرم بوده که هر کدام از این پارامترها دارای مزایا و معایب خاص خود میباشند. سطح آهن سرم و TIBC در تشخیص مراحل پیشرفته آنمی فقر آهن مفید بوده اما حساسیت آنها در تشخیص مراحل اولیه آنمی فقر آهن، محدود است. برعکس، سطح فریتین سرم در تشخیص مراحل اولیه آنمی فقر آهن، بسیار مفید بوده؛ اما مزایای آن تحتالشعاع افزایش غیر اختصاصی آن در بیماریهای التهابی و آسیب سلولهای کبدی (Hepatocellular disease) قرار گرفته است، از این رو نیاز به مارکر بهتری برای ارزیابی وضعیت بدن احساس میشد که با معرفی sTfR به این نیاز پاسخ داده شده است.
اغلب سلولهای بدن در سطح خود دارای رسپتورهای ترانسفرین بوده که وظیفه آنها انتقال آهن متصل شده به ترانسفرین پلاسما به درون سلول میباشد. این رسپتورهای محلول ترانسفرین جزء گلیکوپروتئینهای گذرنده از عرض غشای سلولی (Trans-membrane glycoprotein) بوده که میزان برداشت آهن موجود در گردش خون به درون سلولها را بر عهده دارند. در داخل خون، آهن از طریق اتصال به ترانسفرین منتقل شده و ترانسفرین نیز از طریق اتصال به رسپتورهای ویژه ترانسفرین (TfR) در سطح سلولهای هدف و با کمک پدیده اندوسیتوز، آهن خود را به درون سلولها منتقل مینماید.
در نتیجه pH پایین اندوزومها، آهن به درون سیتوپلاسم آزاد شده و ترانسفرین آزاد شدهی فاقد آهن نیز مجدداً به رسپتور سطح سلولی خود متصل شده و به سطح سلولی برمیگردد و متعاقب آن آزاد میشود. تراکم این رسپتورهای سطح سلولی در ردههای گلبولهای قرمز مغز استخوان و جفت از سایر بافتها بیشتر بوده که به خاطر نیاز بیشتر این دو بافت به آهن در مقایسه با سایر بافتها میباشد.
تعداد رسپتورهای محلول در سرم و یا پلاسما با تعداد آنها در غشاء سلول متناسب است. نیاز متابولیک سلولهای دارای کمبود آهن، نیاز به افزایش تولید رسپتورهای ترانسفرین سطح سلولی (TfR) به منظور تسهیل برداشت بیشتر آهن و سرکوب سنتز فریتین میباشد. برعکس، در طی افزایش محتوای آهن سلولها، سنتز فریتین افزایش و تولید TfR، سرکوب میگردد.
sTfR در سرم نیز قابل تشخیص بوده و به عنوان یک مارکر بسیار خوب برای نشان دادن تولید گلبولهای قرمز (Erythropoiesis) معرفی شده است. سطح sTfR سرمی در بیماران با فقر آهن و در شرایط با هیپرپلازی رده گلبولهای قرمز (Erythroid hyperplasia) از قبیل آنمی همولیتیک، بتا تالاسمی و پلیسیتمی افزایش و در شرایط هیپوپلازی رده گلبولهای قرمز (Erythroid hypoplasia) از قبیل آنمی آپلاستیک، کاهش مییابد. مهمترین ارزش اندازهگیری sTfR کمک به تشخیص افتراقی آنمیهای میکروسیتیک میباشد. افزایش سطح sTfR سرمی، منعکس کننده کاهش آهن درون سلولی بوده و اندازهگیری آن به افتراق آنمی ناشی از التهاب از آنمی ناشی از فقر آهن کمک میکند.
TfR جدیدترین آزمایشی است که فقر آهن را در سطح سلولی بررسی مینماید. این آزمایش اندیکاتور بهتری برای ارزیابی وضعیت آهن بدن بوده و همچنین تحت تأثیر التهاب و سن نیز قرار نمیگیرد. در طی کاهش آهن به منظور کاهش جبران آن، میزان این رسپتورها افزایش مییابد. میزان رسپتورهای فوق در آنمی فقر آهن به میزان ۳ تا ۴ برابر میزان طبیعی افزایش مییابد.
ارزش آزمایش sTfR در تشخیص آنمی فقر آهن، قابل مقایسه با فریتین بوده و همچنین توانایی افتراق آنمی ناشی از بیماریهای مزمن از آنمی ناشی از فقر آهن به ویژه در افراد مسن را نیز دارا میباشد. غلظت sTfR در آنمی فقر آهن با یک شیب تند افزایش یافته؛ در حالی که غلظت آن در آنمی ناشی از بیماریهای مزمن کاهش مییابد. اهمیت افتراق آنمی ناشی از فقر آهن از آنمی ناشی از بیماریهای مزمن در درمانهای متفاوت این دو بیماری بوده و بنابراین ضرورت دارد که بتوان با کمک آزمایشهای غیر تهاجمی از قبیل sTfR، این دو اختلال را از یکدیگر افتراق داد.
تاکنون بررسی مغز استخوان به عنوان مارکر قطعی تشخیص فقر آهن مطرح بود که با توجه به تهاجمی بودن این روش و رضایت کمتر بیماران از انجام این آزمایش، انجام آن را با مشکل همراه میساخت. افزایش sTfR در تشخیص آنمی فقر آهن دارای حساسیت و اختصاصیت ۱۰۰% است؛ در حالی که میزان حساسیت و اختصاصیت کاهش sTfR در تشخیص آنمی ناشی از بیماریهای مزمن به ترتیب ۶/۶۶% و ۱۰۰% میباشد.
هنگامی که میزان فریتین سرم و یا پلاسما از ۱۲ میکروگرم در لیتر کمتر شود، این رسپتورها شروع به افزایش میکنند. برخلاف فریتین، میزان این رسپتورها در بیماریهای التهابی و یا کبدی تغییر نمییابد و از این رو میتواند در افتراق آنمی فقر آهن از آنمی بیماریهای مزمن مفید باشد. سطح sTfR در بیماران دارای آنمی فقر آهن دارای رابطه معکوس با سطح فریتین سرم، غلظت هموگلوبین، MCV و MCH است. اعتقاد بر این است که در آنمی فقر آهن، میزان این رسپتورها نسبت به سایر پارامترها از قبیل MCV و پروتوپورفیرین گلبولهای قرمز سریعتر تغییر نموده و از این رو شاخص حساستری نسبت به MCV و پروتوپورفیرین گلبولهای قرمز بشمار میرود. همچنین نشان داده شده است که اندازهگیری sTfR به منظور تشخیص آنمی فقر آهن در طی حاملگی شاخص مناسبتری در مقایسه با فریتین، پروتوپورفیرین گلبولهای قرمز و MCV میباشد.
روشهای اندازهگیری sTfR
اندازهگیری sTfR میتواند از طریق Enzyme immunoassay صورت گیرد.
فراپژوهش