سیستم گروه خونی ABO و RH
کنترل کیفی و تازههای گروهبندی سیستم گروه خونی ABO و RH
(قسمت اول)
ژنهای سیستم ABO بر روی کروموزوم ۹ و دارای ۷ اگزون میباشند. اگزونهای ۶ و ۷ حدود ۷۷% ژن را دربرگرفته و حاوی رموز اصلی برای عملکرد کاتالیزوری آنزیمهای گلیکوزیل ترانسفراز برای شکل دادن گروه خون هستند. تاکنون بیش از ۲۰۰ آلل ژنی در سیستم ABOشناخته شده است که منجر به تشکیل گروههای فرعی و ترانسفرازهای هیبرید میگردند.
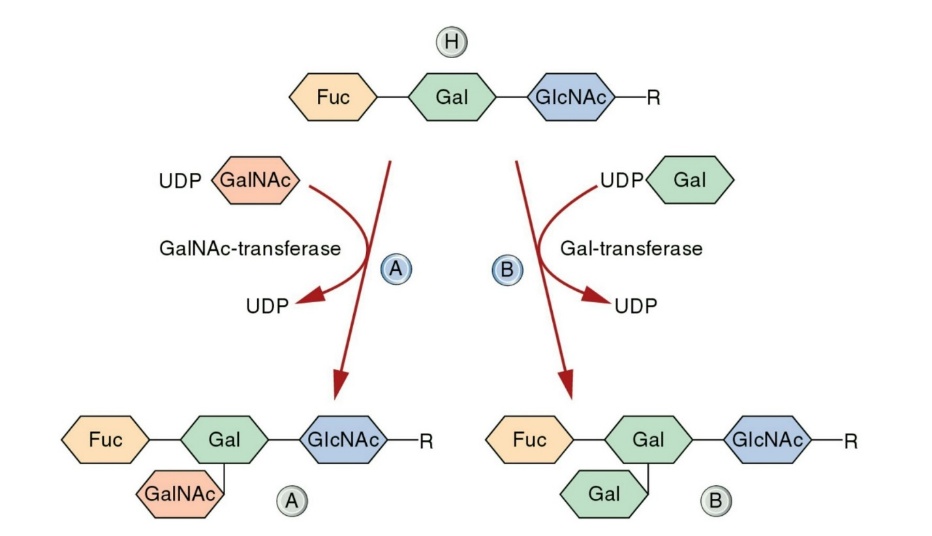
فراورده ژنهای گروه خون ABO، آنزیمهای ترانسفراز است که با انتقال قند استیل گالاکتوز آمین به ساختارهای قندی موجود در سطح گلبول گروه خون A و با انتقال قند گالاکتوز، گروه خونی B را شکل میدهند. برای شکل گرفتن گروههای خونی سیستم ABO فوکوزیله شدن ساختارهای قندی الزامی است
طرح یک پرسش
ممکن است این پرسش مطرح گردد که با وجود ۳۵ سیستم گروه خونی که حدود حداقل ۴۰۰ آنتیژن را در سطح گلبول شکل میدهند چرا در تزریق خون تنها سازگاری سیستمهای ABO و RH چک میشوند؟
تابلوی زیر آنتیژنسیته و قدرت تحریککنندگی چند آنتیژن مهم گروه خونی به غیر از ABO را نشان میدهد. کنترل همگروهی سیستم ABO فوقالعاده بحرانی و اساسی است زیرا تزریق حتی ۲ سیسی خون غیرهمگروه با فعال کردن سیستمیک کمپلمان و انعقاد میتواند منجر به نارسایی کلیه و شوک گردد.
قدرت تحریککنندگی آنتیژن D از سیستم ارهاش ۷۰ درصد است؛ بدین مفهوم که اگر یک واحد خون ارهاش مثبت به منفی تزریق شود به احتمال ۷۰ درصد آنتی D ساخته میشود، درحالیکه قدرت آنتیژنی K از سیستم گروه خونی Kell حدود ۰/۱ درصد است، یعنی اگر یک واحد خون +K به بیمار – K تزریق شود شانس ساخته شدن آنتی K ده درصد است. آنتیژن C دارای قدرت آنتیژنی ۰/۰۴ وآنتیژن Fya دارای قدرت ۰/۰۰۴۶ است که به ترتیب شانس ساخته شدن آنتیبادی با تزریق یک واحد خون، ۴ و ۰/۴۶ درصد میباشد، از اینرو آنتیژنهای ABO و D رکن اساسی تزریق خون میباشند.

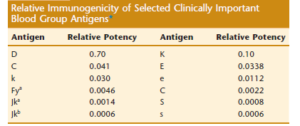
قدرت آنتیژنسیته آنتیژنهای مختلف گروه خونی
آنتیبادیهای سیستم ABO
آنتیبادیهای سیستم ABO از مهمترین آنتیبادیهای گروه خونی در انتقال خون و پیوند بافت میباشند. آنتیژنهای ABO نه تنها روی گلبولهای قرمز بلکه روی همه سلولهای بدن وجود دارند و ازاینرو حضور آنتیبادیهای ناسازگار سیستم گروه خون ABO، موجب رد فوق حاد پیوند میگردد، برای مثال پیوند کلیه A به بیمار O موجب پس زدن بافت کلیه در اتاق عمل میگردد. واکنش آنتی A با آنتیژن A موجب مرگ سلولهای اندوتلیال کلیه و پسزدن کلیه میشود. اهداکننده عمومی بافت از گروه O یا A۲ است. آنتیبادیهای سیستم ABO بهطور غالب از گروه IgM بوده و با تزریق خون ناسازگار موجب همولیز گلبولهای قرمز، فعال شدن گسترده کمپلمان و فعال شدن سیستم انعقاد خون میگردد که پدیدههای انعقاد داخل عروقی منتشره، شوک و نکروز حاد توبولی کلیه را به دنبال خواهد داشت.
عیار آنتیبادیهای سیستم ABO از ۶ ماهگی بعد از تولد رو به افزایش گذاشته و در ۵ تا ۱۰ سالگی به اوج خود میرسد. عیار آنتی A غالباً در گستره ۲۰۴۸-۳۲ و عیار آنتی B در گستره ۵۱۲-۸ قرار میگیرند. عیار آنتیبادیها در دختربچهها بیشتر از پسربچهها است. گفتنی است که آنتیبادیهای سیستم گروه خون ABO در پاسخ به تحریک پلیساکارید میکروبها شکل میگیرد که دارای واکنش متقاطع با آنتیژنهای گروه خون میگردند. بنا به قانون لاند اشتاینر، افراد با گروه خون A دارای Anti B و افراد گروه B دارای Anti A و افراد O دارای Anti A و Anti Bو Anti AB و افراد AB فاقد آنتیبادیهای گروه خونی میباشند.
بخش بزرگی از Anti AB بهصورت IgG AntiAB است که عبور آن از جفت میتواند موجب همولیز و ژاندیس در نوزادان با گروه A یاB گردد. ناسازگاری ABO بین مادر و جنین در اکثر موارد در مادران با گروه O رخ میدهد.
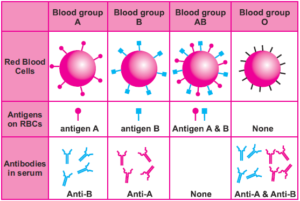
آنتیژنهای ABO بهصورت ترکیبات قندی در سطح غشاء گلبول قرمز و سایر سلولهای بدن نمایان میشوند
گفتنی است که در دو دهه اخیر مصرف غذاهای کنسروشده و استریل موجب کاهش عیار آنتیبادیهای سیستم ABO گردیده که به نظر میرسد با ورود محصولات غذایی پروبیوتیک که حاوی میکروبهای زنده هستند روند افزایش عیار آنتیبادیها مشاهده گردد و در مواردی تزریق پلاسمای ناسازگار اهداکننده حتی در مقدار اندک که در فرآوردههای کرایو و پلاکت وجود دارد موجب واکنش حاد همولیتیک به علت افزایش عیار آنتیبادی گردیده است.
تحریک ایمنی با آنتیژنهای A و B موجب ساخته شدن آنتی A و آنتی B از جنس IgG با عیار بالا میشود، درحالیکه آنتیبادیهای سیستم ABO در غیاب تحریک ایمنی بهصورت رخداد طبیعی و از نوع IgM هستند.
بنا به استانداردها، گروهبندی سیستم ABO برای هر فرد با سن بیشتر از ۶ ماه نیاز به تایپ سلولی و تایپ سرمی دارند که جواب هر دو گروهبندی باید تأییدکننده همدیگر باشند، برای مثال اگر تایپ سلولی، گروه O گردد بایستی سرم دارای Anti A و Anti B باشد. جدول زیر گروهبندی با استفاده از گلبولهای قرمز و سرم را نشان میدهد.
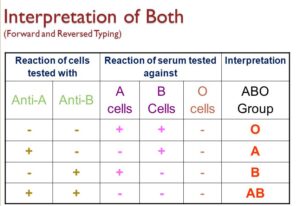
آنتیژنهای سیستم ABO از ۵ تا ۶ هفتگی دوران جنینی شکل میگیرند، درحالیکه آنتیبادیهای گروه خونی پس از ۴ تا ۶ ماهگی از تولد تولید میشود. عیار آنتیبادیهای ABO در ۵ تا ۱۰ سالگی به اوج خود رسیده و در دختربچهها بیشتر از پسران میباشد. عیار آنتیبادیها در سن بالای ۷۵ اندکی رو به زوال میرود
آنتیبادیهای سیستم ABO پس از تولد شکل میگیرند و در ۳ تا ۶ ماهگی دارای عیار کافی برای تعیین گروه خونی به روش بکتایپ میگردند. قبل از سهماهگی آنتیبادیهای مادر از نوع IgG در سرم نوزاد وجود دارد و ازاینرو تایپ گروه خونی به روش سرمی قابل اطمینان نیست، گرچه در سنین پیری عیار آنتیبادیها افت میکند ولی بهاندازه کافی برای تعیین گروه خونی در سرم وجود دارد. سفارش میشود که گلبولهای مورد استفاده برای تایپ سرمی از گروه منفی انتخاب شوند زیرا از نظر آماری شیوع آنتی D بیشتر بوده و از طرفی تزریق آمپول روگام که از جنس آنتی D است ممکن است در بکتایپ سیستم ABO ایجاد تناقض کند. روگام جهت جلوگیری از ایمونوزاسیون Rh و در درمان ترومبوسیتوپنی ایمونولوژیک در افراد Rh مثبت به کار میرود. روگام با ایجاد کمپلکس با گلبولهای قرمز Rh مثبت ماکروفاژها را به فاگوسیتوز گلبولهای قرمز مشغول کرده و مانع فاگوسیتوز پلاکتها در این بیماران میگردد.
گروهبندی سیستم ABO در بیماران با پیوند سلول مادر خونساز:
در پیوند سلولهای بنیادین خونساز، غیرهمگروهی سیستم ABO مانع رد پیوند نمیگردد زیرا آنتیژنهای ABO روی سطح سلولهای مادر وجود ندارند، ازاینرو پیوند سلول مادر A به O یا B به O مانع رد پیوند نمیگردد، برای مثال در پیوند سلول بنیادین خونساز O به A پس از مدتی گلبولهای قرمز مخلوطی از A و O گردیده که پس از حدود سه ماه گروه خون بهصورت خالص O میگردد؛ توجه داشته باشید در این حالت فقط Anti B در سرم یافت میشود و با توجه به اینکه آنتیژن A روی تمام بافتهای بدن وجود دارد القای تولرانس رخ داده و Anti A ساخته نمیشود.
نکات مهم در گروهبندی و تهیه خون و فرآوردهها برای بیمارانی که پیوند با سلولهای مادر خونساز داشتهاند:
- برای جلوگیری از واکنش گرافت کیسههای خون و پلاکت موردنیاز بایستی اشعه داده شود.
- خون انتخابی در هفتههای اول پیوند بایستی همگروه بیمار باشد و با سرم بیمار کراسمچ گردد.
- مشاهده میکسدفیلد در هنگام سلتایپ سیستم ABO بیانگر ورود گلبولهای قرمز پیوند شده است.
- مثبت شدن آزمایش کومبز مستقیم
توجه داشته باشید که تهیه سلولهای مادر از اهداکننده با روش لکوفرز و با بسیج سلولهای مادر از مغز استخوان به خون محیطی صورت میگیرد و ۵ روز پس از تزریق G-CSF(۱۰-۱۶μg/kg) سلولهای مادر که از مغز استخوان وارد خون محیطی شدهاند، توسط لکوفرز جدا میگردند. دوزاژ سلول مادر برای یک پیوند موفقیتآمیز (kg۱۰۶×(۲-۵ از سلولهای +CD۳۴ است. جمعآوری سلولهای مادر بهطور چشمگیر با گلبولهای قرمز دهنده آلوده میگردد که در صورت ناسازگاری، واکنش حاد همولیتیک را در پی خواهد داشت و ازاینرو در پیوند غیرهمگروه تلاش میشود که عیار آنتیبادیهای ABO در بیمار با پلاسمافرز به کمتر از ۱۶یا ۸ تقلیل یابد. رخداد واکنش همولیتیک تولید گلبولهای قرمز و پلاکت از سلول مادر پیوندی را به تأخیر میاندازد.
در پیوند سلولهای مادر خونساز، پدیده تولرانس رخ داده و ممکن است آنتیبادیهای قابلانتظار مشاهده نشود؛ مثلاً در پیوند گروه O به AB چنانچه پیوند موفقیتآمیز باشد معمولاً بعد از ۲۰ روز گلبولهای O در خون بیمار ظاهر شده و گلبولهای بیمار مخلوط AB و O میگردد که پس از چند ماه به گروه O تبدیل میشود. در این حالت برخلاف انتظار، Anti AB در سرم یافت نمیشود، زیرا تمام بافتهای دیگر بدن بیمار حاوی آنتیژن A و Bمیباشد. از طرف دیگر گاهی ممکن است به دلیل داروهای سرکوبگر ایمنی هیچگونه آنتیبادی در بکتایپ پیدا نشود.
گروههای فرعی A
گروههای فرعی A دارای اهمیت میباشند و ممکن است با تناقص گروهبندی در تایپ سلولی و سرمی همراه باشند. گروههای A۱ و A۲ حدود ۹۹ درصد گروه A را تشکیل میدهند و گروههای فرعی دیگر مانند A۳، Ax، Am،Ael و …. تنها ۱ درصد جمعیت A را شکل میدهند. هر گلبول A۱ حاوی حدود یک میلیون سایت آنتیژنی A و هر گلبول A۲ حدود ۲۴۰۰۰۰ سایت آنتیژنی A میباشند. گاهی در گروههای فرعی A آنقدر آنتیژن A ضعیف میشود که گلبولهای قرمز در تایپ سلولی با آنتی A واکنش نداده و ممکن است بهصورت گروه O درآید. در گروه A۳ هر گلبول حاوی ۳۵۰۰۰ قند اختصاصی A بوده و با آنتی A و آنتی AB آگلوتیناسیون میکسد (مخلوط) میدهد. هر گلبول Ax دارای ۵۰۰۰ قند اختصاصی A بوده و بهراحتی آنتی A را جذب کرده ولی با آن آگلوتینه نمیدهد. آنتی AB ممکن است با گلبولهای Ax واکنش +۲ دهد. تعداد آنتیژنهای اختصاصی گروه A در گروههای فرعی Ael و Aend کمتر از ۲۰۰۰ بوده و در سلتایپ با گروهO اشتباه میشوند.
تضعیف آنتیژنهای گروه خون
ناپدید شدن آنتیژنهای ABO در لوسمیها ناشی از کاهش فعالیت ترانسفرازها میباشد. تضعیف آنتیژن A در لوسمیها به Ag نمایش داده تا این حالت اکتسابی با گروههای فرعی ضعیف A که به ارث میرسند اشتباه نگردد.
لوسمی، جابجایی کروموزومی ۹ (translocation) و کمخونیهای همولیتیک که با هماتوپوئز تحت استرس از قبیل تالاسمی، الیپتوسیتوز همولیتیک و … همراه هستند موجب افت تراکم آنتیژنهای گروه خونی به علت ریزش پروتئینهای غشا در سیتوپلاسم میگردند و تایپ سلولی در آزمایشگاه بهصورت ضعیف یا میکسد فیلد درمیآید. توجه داشته باشید که ژن گروه خونی ABO روی کروموزوم ۹ بوده و جابجایی آن موجب بروز ترانسفرازهای ناهنجار گروه خونی میگردد.
گزارش گردیده است که در لنفوم هاجکین آنتیژنهای گروه خونی شبیه لوسمیها ضعیف میگردند و بهبودی از لوسمی یا لنفوم با افزایش دوباره بیان آنتیژنها همراه میشود.
تغییر گروه خون
گروه خون ارثی است، ازاینرو تغییر گروه خون بازتابی از یک بیماری پرخطر زمینه بوده که پس از درمان بیماری زمینه به حالت اول برمیگردد.
سرطان روده با انسداد یا افزایش نفوذپذیری، موجب ورود پلیساکارید میکروب E.coli O۸۶ از روده بزرگ به خون شده و چنانچه توسط سلولهای خون جذب گردند با آنتی B واکنش داده و پدیده B کاذب را سبب میشوند. پدیده B کاذب نیز ممکن است ناشی از ورود آنزیم داستیلاز (deacetylase) و برداشت گروه استیل از قند اختصاصی A (استیل گالاکتوز امین) باشد که آن را شبیه به قند اختصاصی B (گالاکتوز آمین) میکند. در این حالت تایپ سلولی، گروه AB و بکتایپ، گروه A که گروه واقعی بیمار است را نشان میدهد.
سرطانهای معده، روده، پانکراس و تخمدان با ترشح زیاد آنتیژنهای اختصاصی گروه خون بهویژه در گروه A موجب خنثیسازی معرف آنتی A یا آنتی B گردیده و موجب تناقص در تایپ سلولی و سرمی میگردند. شستن ۲ تا ۳ بار نمونه خون برای پاک کردن مواد ترشحی موجب رفع خطا در تایپ سلولی میگردد، در غیر این صورت معرف آنتی A یا آنتی B توسط انبوه مواد ترشحی در خون شسته نشده خنثی شده و قدرتی برای واکنش با آنتیژنهای گروه خون نداشته و واکنش منفی کاذب میدهد.
آللهای گروه خونی O
ژن گروه خون O دارای دو آلل عمدهی O۱ و O۲است، در آلل O۱ که حدود ۹۵ درصد آلل شایع O را در بر میگیرد، حذف نوکلئوتید G۲۶۱ منجر به تغییر قرائت ژنتیکی و ختم زودرس سنتز فراورده پروتئینی آن میگردد در این حالت گلبولهای قرمز فاقد آنتیژنهای A و Bبوده و در سرم آنتی A و آنتی B یافت میشود. در آلل O۲ جهش G۸۰۲> A منجر به جایگزینی آرژنین با گلایسین در موقعیت ۲۶۸ ترانسفراز میگردد، گفتنی است که گروه O در این حالت با فقدان آنتی A و یا آنتی Bهمراه است.
همیشه برای انجام گروه خونی اطلاعات مربوط به سن بیمار، تشخیص بیماری، تاریخچه تزریق خون و فرآوردهها، سابقه دارویی و حاملگی را مدنظر قرار دهید، برای مثال میتوان به ضعیف شدن آنتیبادیها در پیری و کاهش تراکم آنتیژنها در لوسمیها و کمخونیهای همولیتیک اشاره کرد. ورود آنتیبادیهای ناخواسته با تزریق فرآوردههای پلاسمایی غیرهمگروه و یا تزریق IvIg (ایمونوگلوبین تزریق وریدی) با اختلال در تایپ سرمی همراه میشود. افزایش فیبرینوژن در حاملگی و افزایش ایمونوگلوبولینها در مالتیپل میلوما با ایجاد پدیده رولکس موجب خطای سلتایپ و تایپ سرمی میگردد.
توجه داشته باشید که واکنشهای سرولوژیک آگلوتیناسیون در تایپ سرمی و سلولی دارای درجه +۳ و +۴ هستند و واکنشهای +۱ نیاز به بررسی بیشتر سرولوژیک دارند. با مشاهده تناقض، اولین کار انجام مجدد گروهبندی روی خون سه بار شستهشده است.
واکنشهای غیر قابلانتظار در تایپ سرمی
چنانچه تایپ سرمی، واکنش قابلانتظار با توجه به آنتیبادیهای موردنظر ندهد، به موارد زیر فکر کنید: نوزاد، افراد مسن، لنفوم و لوسمی، هایپوگاماگلوبولینمی، داروهای سرکوبکننده ایمنی، بیماریهای کمبود ایمنی ارثی و اکتسابی، انتقال پاسیو آنتیبادیها از طریق فرآوردههای پلاسمایی و تزریق IvIg، پیوند سلولهای بنیادین خونساز، گروههای فرعی ABO و پدیده تأخیری پروزون (prozone).
کاهش ایمنی همورال اکتسابی و ارثی موجب تناقض در تایپ سرمی میگردد. لوسمی مزمن لنفوسیتیک و لنفوم غیرهاجکین ممکن است با کاهش ایمونوگلوبین همراه گردند. در سندرم ویسکوت آلدریچ که یک بیماری کمبود ایمنی میباشد، بیمار توانایی ساختن آنتیبادی علیه آنتیژنهای پلیساکاریدی را نداشته و بکتایپ فقدان آنتیبادی را نشان میدهد.
حضور آنتیبادیهای غیرمنتظره در گروه خونی فرعی A
- حضور آنتی A۱ در گروههای فرعی A۲ (۱ تا ۸ درصد) و A۲B (۲۲ تا ۳۵ درصد)، Ax (اکثر موارد) و A۳ (گاهی) موجب تناقض در تایپ سلولی و سرمی گردیده و تایپ سرمی را بهصورت گروه O درمیآورد. با استفاده از لکتین دولیشوس که تنها با گلبولهای قرمز A۱ و A۱B واکنش میدهد میتوان گروههای A۱و A۱B را از A۲ و A۲B جدا ساخت.
- امکان دارد آنتی A در گروههای خونی B و O به علت عیار بالا و قدرت زیاد در فیکس کردن کمپلمان C۱q موجب پوشش فضایی آنتیژنهای A گشته و مانع آگلوتیناسیون گلبولهای قرمزA۱ در بکتایپ گردد که به آن پدیده پروزون (prozone) تأخیری گویند، ازاینرو سانتریفیوژ کردن سریع لولههای بکتایپ برای جلوگیری از این پدیده سفارش میشود. برای حل مشکل پدیده پروزون تأخیری میتوان سوسپانسیون گلبولهای A و Bکه در تایپ سرمی استفاده میشود را EDTAدار کرد، املاح EDTA با جلوگیری از فعالیت کمپلمان مانع آغشته شدن گلبولهای قرمز با انبوه C۱q میگردند.
پیوند بافت توپر و گروهبندی سیستم ABO
در پیوند بافت توپر مانند کلیه و کبد چنانچه تشابه گروه ABO بین دهنده و بیمار نباشد، برای مثال در پیوند کبد یا کلیه از دهنده O به بیمار A یا B، پدیده لنفوسیتهای مهاجر رخ میدهد؛ بدین مفهوم که سیستم لنفوئیدی دهنده در شبکه مویرگی کبد و کلیه موجود بوده و برای مدتی Anti AB را سنتز میکند که نتیجه آن مثبت شدن ضعیف آزمایش کومبز مستقیم متعاقب پیوند است. این پدیده تا حدود سه هفته ادامه داشته و چنانچه در این زمان به خون نیاز داشته باشد بایستی از گروه O استفاده کرد.
ایمونوگلوبولینهای تزریق وریدی و اختلالات گروهبندی
ایمونوگلوبولینهای تزریق وریدی (IVIG)در دوزاژ بالا برای درمان برخی از بیماریها از قبیل ترومبوسیتوپنی ایمونولوژیک، بیماری کاواساکی، بیماری گیلنباره، نوروپاتیها و … کاربرد گسترده دارد و موجب تناقض در تایپ سرمی و دریافت پاسخهای اشتباه در آزمایش اسکرین آنتیبادیها و آزمایشهای سرولوژیک بیماریهای عفونی و مثبت کاذب کومبز مستقیم میگردد، ازاینرو چنانچه در گروهبندی با تناقض پیچیده در گروهبندی سلولی و سرمی مواجه گردیدید، از گروه O برای تزریق استفاده کنید.
فراپژوهش