آنتیبیوتیکهایی که سنتز پروتئین را مهار میکنند
اصول کلی
برخلاف سلولهای انسانی که دارای ریبوزوم s۸۰ هستند، باکتریها سنتز پروتئینشان را با استفاده از ریبوزوم s۷۰ انجام میدهند. ریبوزوم باکتری از قطعات s۵۰ و s۳۰ تشکیل شده و اطراف mRNA پلیسیسترونی که از روی کروموزوم نسخه برداری شده است را گرفتهاند.
هدف تعدادی از آنتیبیوتیکها، مراحل اختصاصی سنتز پروتئین است که به قطعات s۵۰ یا s۳۰ ریبوزوم وابسته است. از آنجایی که مکانیسم سنتز پروتئین در باکتریها با سلولهای انسانی متفاوت است، این آنتیبیوتیکها برای باکتریها سمیت انتخابی دارند. البته، آنتیبیوتیکهایی که سنتز پروتئین باکتریها را مهار میکنند، ممکن است در غلظت بالا بر روی سنتز پروتئین یوکاریوتی نیز تأثیر بگذارند. از طرفی، میتوکندری دارای ریبوزوم s۷۰ است. بعضی از آنتیبیوتیکها که به میزان کافی در سلول میزبان تجمع مییابند، میتوانند به بافتهایی (نظیر مغز استخوان) که غنی از میتوکندریاند، صدمه بزنند. بیشتر آنتیبیوتیکهای مهارکننده سنتز پروتئین باکتریواستاتیکاند، البته آمینوگلیگوزیدها در غلظت فیزیولوژیک، برای بیشتر باکتریهای حساس باکتریوساید هستند.
عوامل مؤثر بر زیرواحد S ۵۰ ریبوزوم
کلرامفنیکل، ماکرولیدها و لینکوزامیدها بررویزیرواحد s۵۰ ریبوزم اثر میگذارند.
کلرامفنیکل
ویژگی و مکانیسم عمل: کلرامفنیکل (شکل ۱) یک آنتیبیوتیک باکتریواستاتیک است که مانع عمل آنزیم پپتیدیل ترانسفراز و تشکیل باند پپتیدی میشود. به دلیل اثر داروهای باکتریواستاتیک، عموماً این داروها در ترکیب با آنتیبیوتیکهای باکتریوساید (مثل بتالاکتام ها یا آمینوگلیکوزیدها) مصرف نمیشوند.
کاربرد و عوارض دارو: کلرامفنیکل از اولین عوامل ضدمیکروبی کشفشده است که مانع سنتز پروتئین میگردد. از آنجایی که کلرامفنیکل یک آنتیبیوتیک وسیعالطیف است و بهخوبی در سلول میزبان تجمع مییابد، بسیاری معتقد بودند که ممکن است گلوله نقرهای باشد و بتواند تمام پاتوژنها را بکشد. همچنین کلرامفنیکل بهخوبی در سیستم اعصاب مرکزی نفوذ کرده و در مایع مغزی نخاعی تجمع مییابد.
در طی اولین سالهای معرفی این دارو، کلرامفنیکل تقریباً یکسره مصرف میشد، اما وقتی برخی بیماران به دنبال مصرف آن، دچار آنمی آپلاستیک شدند، معلوم شد که اغلب از این دارو استفاده مناسب نشده است. امروزه مشخص شده که این توانایی عالی دارو برای نفوذ به سلول میزبان به خودی خود هم مفید و هم مضر است. برخلاف آنتیبیوتیکهای بتالاکتام که خیلی کم به سلول میزبان نفوذ میکنند، کلرامفنیکل بهخوبی در سیتوپلاسم تجمع مییابد. در این جا هم میتواند باکتریهای درونسلولی را بکشد و هم با سنتز پروتئین میتوکندری تداخل ایجاد کند. همین امر، عامل توانایی کلرامفنیکل برای متوقف و سرکوب کردن فعالیت مغز استخوان و ایجاد آنمی آپلاستیک است. همچنین کلرامفنیکل برای نوزادان نارس سمی است که ممکن است سبب ایجاد سندرم گری در کودکان شود، به همین دلیل، در ایالات متحده آمریکا پزشکان زیاد از کلرامفنیکل برای درمان بیماران استفاده نمیکنند. البته مصرف مناسب آن سبب درمان عفونتهای ناشی از کلامیدیا سیتاسی (پسیتاکوزیس)، هموفیلوس انفلوانزا (مننژیت)، سویههای ریکتزیا (تب دانهدار کوههای راکی)، تیفوس و سایر بیماریهای ریکتزیائی)، سروتایپ سالمونلا تیفی (تیفوئید)، یرسینیا انتروکولیتیکا (انتروکولیت) و یرسینیا پستیس (طاعون) میشود.
همه این پاتوژنها بهجز هموفیلوس، پاتوژنهای اجباری و اختیاری داخل سلولی هستند. فایده کلرامفنیکل در درمان مننژیت حاصل از هموفیلوس انفلوانزا بهطور وسیع به توانایی دارو برای تجمع درون مایع مغزی- نخاعی بستگی دارد. در دنیا، کلرامفنیکل یکی از پرمصرفترین آنتیبیوتیکها است.
مقاومت باکتریها به کلرامفنیکل: باکتریهای رودهای ارگانیسمهایی هستند که مکرراً به کلرامفنیکل مقاومت نشان میدهند. در این مورد، مقاومت معمولاً توسط یک فاکتور R پلاسمیدی حاوی ژن مقاومت به کلرامفنیکل و تتراسایکلین روی میدهد. این پلاسمید آنزیمی را کد میکند که با استیلاسیون، کلرامفنیکل را غیرفعال میسازد. معمولاً این نوع مکانیسم مقاومت، در سالمونلا تیفی و سویههای شیگلا روی میدهد. کلرامفنیکل استیلاز به محیط آزاد شده و ایجاد پدیده تلقیح میکند (مترجمین: همانند بتالاکتامازهای تولیدی توسط باکتریهای گرم مثبت).
دو مکانیسم دیگر هم برای مقاومت به کلرامفنیکل گزارش شده است. باکتریهای رودهای و سودوموناس گاهی یک فاکتور R دارند که سبب کاهش نفوذپذیری دارو به داخل باکتری میشوند. سایر باکتریها گاهی دچار جهش در ژنهای کروموزومی میشوند که مربوط به زیرواحد s۵۰ ریبوزومی است و سبب میگردد که آنتیبیوتیک بهسختی توسط هدفش شناسایی شود.
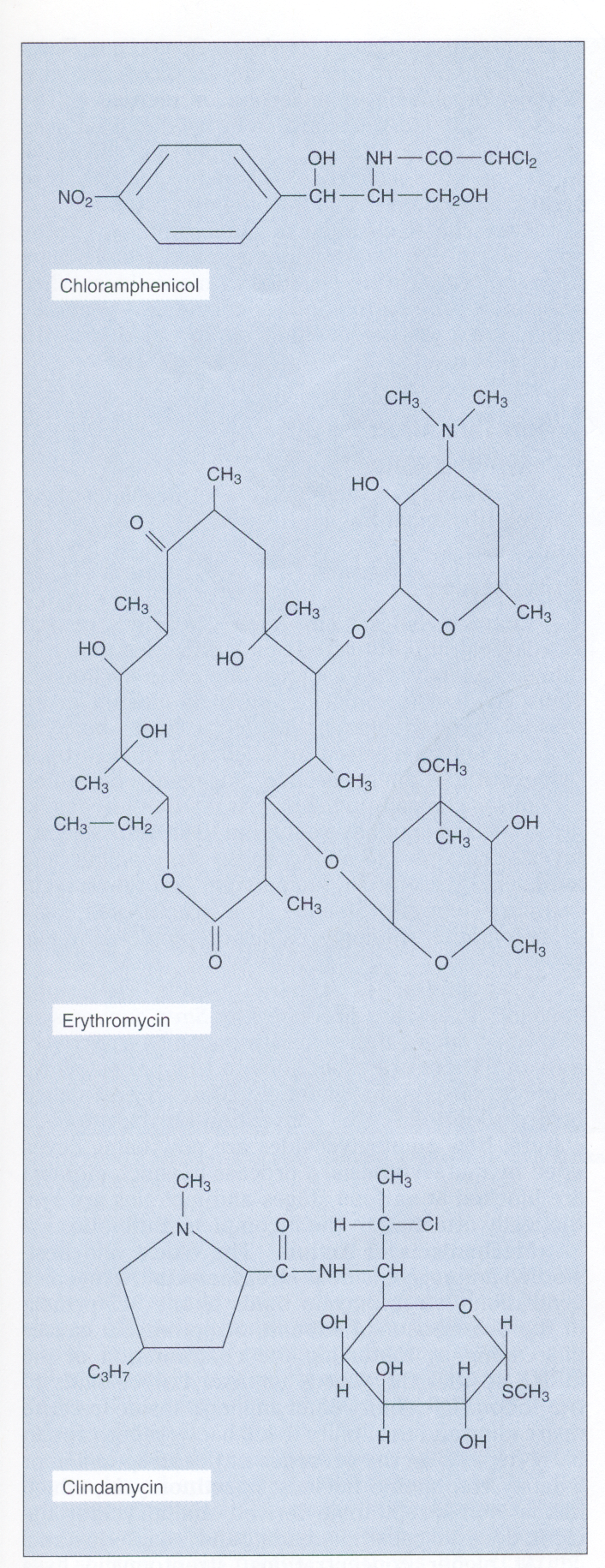
شکل ۱- ساختمان کلرامفنیکل، اریترومایسین و کلیندامایسین
این آنتیبیوتیکها روی عملکرد زیرواحد s۵۰ ریبوزوم اثر میکنند. اریترومایسین یک آنتیبیوتیک ماکرولیدی و دارای گروه لاکتون است. کلیندامایسین از نظر ساختاری با ماکرولیدها مرتبط نبوده ولی دارای طیف اثر مشابه است و بهوسیله مکانیسمهای مقاومت مشابه غیرفعال میشود
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
اریترومایسین و سایر ماکرولیدها
ویژگی و مکانیسم عمل: آنتیبیوتیکهای ماکرولیدی، مولکولهای بزرگ حلقوی هستند که دارای یک حلقه لاکتون هستند. اریترومایسین (شکل ۱)، سالها تنها ماکرولید موجود بود، اما افزایش سطح مقاومت به این آنتیبیوتیک در باکتریها، منجر به پیدایش ماکرولیدهای جدید آزیترومایسین، کلاریترومایسین، دیریترومایسین و ترولیندومایسین شد. آنتیبیوتیکهای ماکرولیدی در غلظت پایین باکتریواستاتیک و در غلظت بالا باکتریوساید هستند.
بیشتر مطالعات مربوط به مکانیسم عمل ماکرولیدها بر روی اریترومایسین متمرکز شده است. اریترومایسین بهطور برگشتناپذیر به ریبوزومهای آزاد میچسبد، اما به پلیزومها (چند ریبوزوم که قطعهای از mRNA پلیسیسترونیک را میخوانند) متصل نمیشود. اریترومایسین در زمان شروع سنتز به ریبوزوم میچسبد و اجازه میدهد پپتید کوچکی تشکیل شود، اما بعداً هرگونه سنتز بعدی را مهار میکند. در این مرحله هم ترانسلوکاسیون و هم طویل شدن متوقف میشود. به دلیل ناپایدار بودن کمپلکس متوقف شده، قطعات ریبوزوم از mRNA جدا میشوند. این قطعات که فعالیتشان همچنان بلوکه است، میتوانند به mRNA جدید متصل شوند.
کاربرد و عوارض دارو: اریترومایسین یک آنتیبیوتیک معمولی است، طیف ضدمیکروبی شبیه به پنیسیلین G دارد (توسط بتالاکتامازها غیرفعال نمیشود)، میتوان آن را بهصورت خوراکی مصرف کرد و در صورت استفاده مناسب، خیلی سمی نیست. بیشتر واکنشهای مضر اریترومایسین مربوط به بهم زدن معده و روده است. اریترومایسین در درمان بیماری لژیونرها، دیفتری، سیاه سرفه و پنومونی آتیپیک حاصل از مایکوپلاسما و کلامیدیا مصرف میشود.
ماکرولیدهای جدید، طیف اثر وسیعتری دارند و راحتتر از اریترومایسین توسط دستگاه گوارش جذب میشوند. به نظر میرسد آزیترومایسین بر ضد بورلیا بورگدوفری (عامل بیماری لایم)، هموفیلوس انفلوانزا و انگل توکسوپلاسما گوندی مؤثر باشد. کلاریترومایسین به این دلیل غیرمعمول است که بر روی مایکوباکتریوم آویوم داخل سلولی و چند مایکوباکتریوم غیرتیپیک مؤثر است. ترولیندومایسین برای درمان پنومونی پنوموککی و ریشهکنی حاملین استرپتوکک پیوژنز در گلو استفاده میشود. روکسی ترومایسین یک داروی تحقیقاتی است که بر ضد هلیکوباکتر پیلوری، موراکسلا کاتارالیس و بعضی سویههای استافیلوکک و بیشتر سویههای استرپتوکک مؤثر است، بعلاوه دارای طیف اثر معمول ماکرولیدها است.
مقاومت باکتریها به ماکرولیدها: باکتریها با دو مکانیسم نسبت به ماکرولیدها مقاوم میشوند. اولاً، بسیاری از باکتریها در ژن کروموزمی سازنده پروتئین L۴ یا L۱۲ زیرواحدs ۵۰ ریبوزومی دچار جهش میشوند. ثانیاً، بعضی باکتریها دارای فاکتور R هستند که آنزیمی را کد میکنند که rRNA s۲۳ را در زیرواحد s۵۰ ریبوزوم دی متیله میکند. در اثر هرکدام از این مکانیسمها، زیرواحد s۵۰ نمیتواند آنتیبیوتیک را شناسایی نماید. وقتی مکانیسم مقاومت، به علت فاکتور R است، باکتری به تمام ماکرولیدها و لینکوزامیدها مقاوم میشود.
لینکومایسین، کلیندامایسین و سایر لینکوزامیدها
ویژگی و مکانیسم عمل: معمولاً لینکوزامیدها با ماکرولیدها به دلیل تشابه طیف فعالیت و مکانیسم عمل نه از نظر شیمیایی در یک گروه قرار میگیرند. لینکوزامیدها شامل آنتیبیوتیکهای لینکومایسین و کلیندامایسین (شکل ۱) هستند. تفاوت کلیندامایسین با لینکوزامیدها داشتن یک گروه کلرین در لینکومایسین بجای گروه هیدروکسیل کلیندامایسین در کربن ۷ است. این تفاوت کلیندامایسین را قادر میسازد که راحتتر جذب شده و برعلیه بیهوازیها مؤثرتر باشد.
لینکوزامیدها به همان گیرنده روی زیرواحد s۵۰ ریبوزوم که کلرامفنیکل میچسبد، متصل میشوند. در اینجا، لینکوزامیدها تشکیل باند پپتیدی را بلوکه میکنند. برخلاف کلرامفنیکل، لینکوزامیدها سبب جدا شدن سریع زیرواحدهای s۵۰ و s۳۰ ریبوزوم از همدیگر میشوند. مکانیسم دقیق عمل لینکوزامیدها هنوز بهخوبی معلوم نیست، اما به نظر میرسد که با مکانهای مشابه آمینوآسیل– tRNA و پپتیدیل tRNA در سرهم کردن ریبوزوم تداخل میکنند.
کاربرد و عوارض دارو: طیف اثر کلیندامایسین شبیه پنیسیلین G و اریترومایسین است، اما کلیندامایسین در درمان عفونتهای حاصل از باکتروئیدس فراژیلیس بیهوازی اجباری، خصوصاً در افراد حساس به پنیسیلین استفاده میشود. گاهی برای درمان آبسهها یا سپسیس حاصل از گونههای باکتروئیدس، اکتینوباسیلوس، اکتینومایسس، کاپنوسایتوفاگا، کلستریدیوم، فلاووباکتریوم، فوزوباکتریوم، یا پپتواسترپتوکوکوس استفاده میشود. بیشتر این باکتریها بیهوازی یا میکروائروفیلیک هستند. کلیندامایسین میتواند برای درمان عفونتهای عمیق استافیلوکوکی مصرف شود. کلیندامایسین در ترکیب با جنتامایسین (یک آمینوگلیکوزید)، برای درمان بیماریهای التهابی لگن استفاده میشود.
مقاومت باکتریها به لینکوزامیدها:
مقاومت باکتریایی به لینکوزامیدها با مقاومت به ماکرولیدها مربوط است. مقاومت به لینکوزامیدها، معمولاً با RNA متیلاز القایی اریترومایسین، که قبلاً توضیح داده شد، همراه است.
عوامل مؤثر بر زیرواحد s ۳۰ ریبوزوم
آمینوگلیکوزیدها و تتراسایکلینها بر روی زیرواحد s ۳۰ ریبوزوم اثر میگذارند.
آمینوگلیکوزیدها
ویژگی: آمینوگلیکوزیدها گروه بزرگی از آنتیبیوتیکها هستند که دارای یک هسته آمینوسیکلیتول میباشند. این حلقه یک مولکول حلقوی نظیر اینوزیتول یا یک قند مشتق از اینوزیتول است که چند گروه هیدروکسیل با گروه آمین آن جانشین شدهاند. کازاگامایسین (که در ایالات متحده آمریکا کاربرد درمانی ندارد) سادهترین آمینوگلیکوزیدی است که دارای اینوزیتول تعویضشده است. استرپتومایسین دارای قند آمینی استرپتامین است و آمیکاسین، جنتامایسین، کانامایسین، توبرامایسین دارای ۲- اکسی استرپتامین هستند. ساختمان چند آمینوگلیکوزید در شکل ۲ ارائه شده است.
معمولاً، آمینوگلیکوزیدهایی که دارای پسوند”مایسین” هستند، توسط سویههای استرپتومایسس تولید میشوند و پسوند “میسین” مربوط به آنهایی است که توسط میکرومونوسپورا ساخته میشوند. البته، به دلیل اینکه بعضی از آمینوگلیکوزیدها قبل از تعیین این تقسیمبندی نامگذاری شدهاند، استثنائاتی در این زمینه وجود دارد. امروزه آمینوگلیکوزیدها توسط موتاسنتتیک تولید میشوند که پروسهای است که در آن موتانتها در مراحل مختلف بلوکه شده و واحدهای جدید بهصورت صنعتی به آنتیبیوتیک ناقص اضافه میشوند.
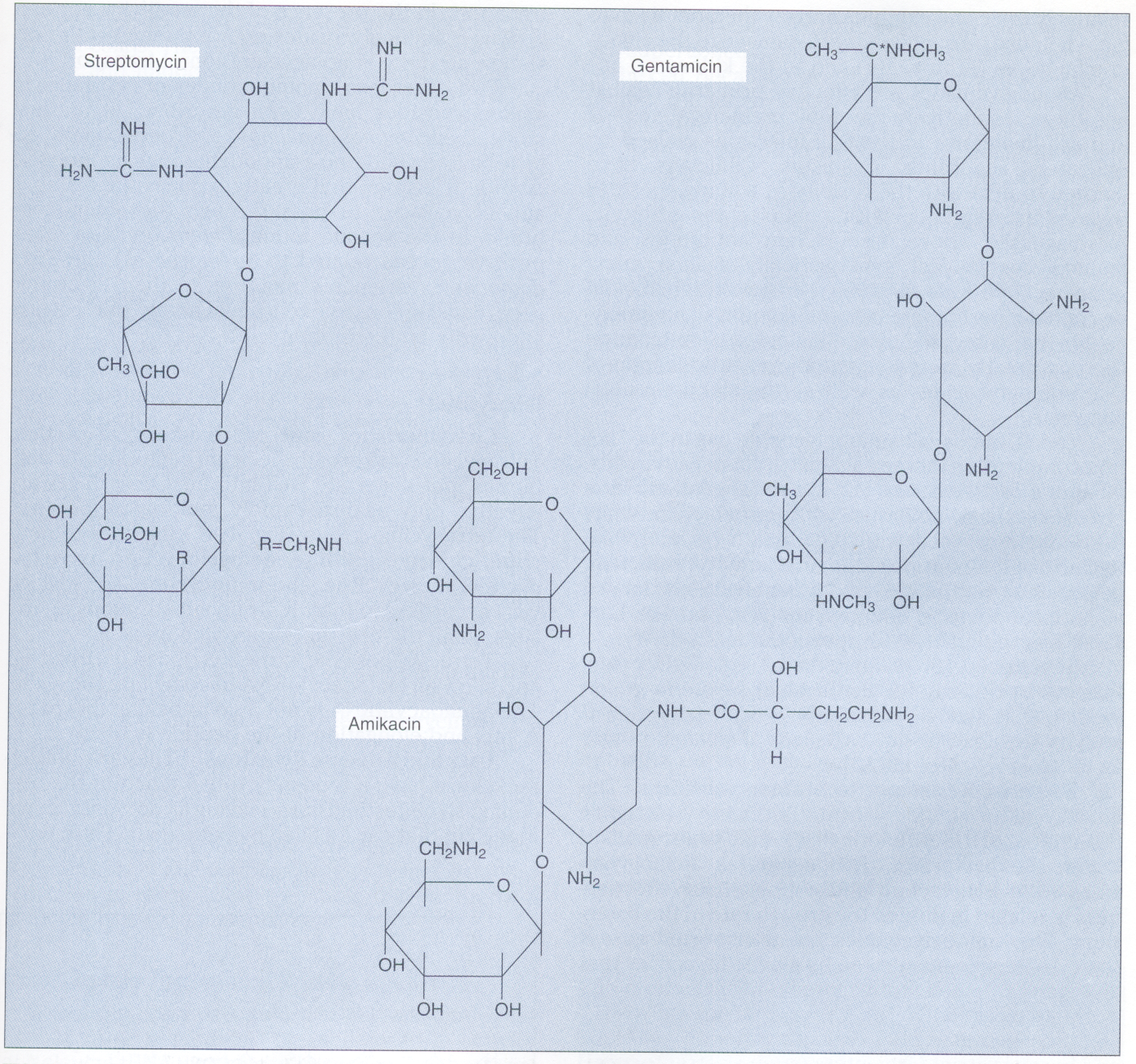
شکل ۲- ساختمان استرپتومایسین، جنتامایسین و آمیکاسین
این آمینوگلیکوزیدها بر روی زیرواحد s۳۰ ریبوزوم عمل میکنند
(برگرفته از کتاب میکروبشناسی پزشکی واکر)
مکانیسم عمل: قدیمیترین و شناختهشدهترین آمینوگلیکوزید، استرپتومایسین است. استرپتومایسین در غلظت کم به پروتئین S۱۲ زیرواحد s۳۰ ریبوزوم میچسبد. استرپتومایسین به علت تخریب شکل mRNA، سبب اشتباه خوانده شدن کدهای ژنتیکی میشود و سبب میگردد که آمینوآسیل– tRNA بطور اشتباه به کدون متصل گردد. توانایی آمینوگلیکوزیدها در ایجاد اشتباه خوانده شدن کد ژنتیکی و توانایی کشتن باکتریها به دلیل وجود یک هسته استرپتامین یا ۲- داکسی استرپتامین است؛ اسپکتینومایسین که دارای یک هسته آمینوسیکلیتول غیرمشتق از استرپتامین است، سبب اشتباه خوانده شدن کدهای ژنتیکی نمیشود.
استرپتومایسین در غلظت بالا، به ریبوزوم چسبیده و با mRNA کمپلکس تشکیل میدهد. در این شرایط tRNA – F-met سنتز پروتئین را آغاز میکند، اما این سنتز بعد از آغاز، ادامه نمییابد. بعد از ۵ دقیقه ریبوزوم تغییریافته از mRNA میافتد. اگر این ریبوزوم با mRNA جدیدی کمپلکس شود، خواندن پیام توسط هر ریبوزوم دیگری را متوقف میکند. این مهار پلیزومها، منجر به توقف کامل سنتز پروتئین میشود.
کاربرد و عوارض دارو: آمینوگلیکوزیدها طیف اثر وسیعی داشته و باکتریوساید هستند. البته چند مورد محدودیت هم دارند:
اولاً، فعالیت باکتریوسیدال آمینوگلیکوزیدها حداقل به سنتز چند پروتئین نیاز دارد؛ بنابراین، کمبود یا مهار برگشتپذیر سنتز پروتئین، با فعالیت آمینوگلیکوزیدها تداخل ایجاد میکند. به همین دلیل آمینوگلیکوزیدها در حضور کلرامفنیکل باکتریوساید نیستند.
دوم، دامنه اثر باکتریوسایدی آمینوگلیکوزیدها با افزایش غلظت دارو زیاد میشود و میزان آنتیبیوتیکی که به باکتری وارد میگردد، فاکتور محدودکننده تأثیر آمینوگلیکوزیدها است.
سوم، آمینوگلیکوزیدها در شرایط بیهوازی بیتأثیرند؛ بنابراین بر ضد بیهوازیهای اجباری مؤثر نیستند. وقتی بیهوازیهای اختیاری، در محیط بیهوازی اجباری قرار میگیرند، قدرت آمینوگلیکوزیدها در مورد این باکتریها ده بار کاهش مییابد.
چهارم، آمینوگلیکوزیدها بر ضد باکتریهایی که در محلهایی قرار گرفتهاند که غلظت اسید و نمک بالا است، بیتأثیر هستند.
پنجم، به دلیل نفوذ کم آمینوگلیکوزیدها به درون سلول، بر ضد باکتریهای داخل سلولی نیز تأثیر ندارند. بالاخره، اینکه آمینوگلیکوزیدها نسبتاً سمیاند و طیف درمانی باریکی دارند و مصرفشان منجر به آسیب عصب هشتم صورتی (اتوتوکسیته) و آسیب کلیوی میشوند.
آمینوگلیکوزیدها بر روی باسیلهای گرم منفی هوازی یا بیهوازی اختیاری مؤثرند و در درمان عفونتهای حاصل از بیهوازیهای اجباری غیرمؤثر هستند. پزشکان متوجه شدهاند که برای غلبه بر سمیت آمینوگلیکوزیدها میتوان آنها را همزمان با آنتیبیوتیکهای بتالاکتام مصرف کرد. چنانکه در بالا توضیح داده شد، آنتیبیوتیکهای بتالاکتام و آمینوگلیکوزیدها بهصورت سینرژیسم بر ضد بسیاری از باسیلهای گرم منفی عمل میکنند. احتمالاً چون پنیسیلینها یا سفالوسپورینها سبب افزایش میزان ورود آمینوگلیکوزیدها به داخل باکتری هدف میشوند. استفاده ترکیبی سبب افزایش وسیع طیف درمانی و طیف ضد میکروبی آمینوگلیکوزیدها میگردد.
امروزه، در ایالات متحده آمریکا تقریباً از تمام آمینوگلیکوزیدها بهصورت درمان ترکیبی بر ضد باسیلهای گرم منفی، حتی سودوموناس استفاده میشود؛ برای مثال، معمولاً جنتامایسین در ترکیب با کاربنیسیلین و توبرامایسین همراه پیپراسیلین یا تیکارسیلین مصرف میگردد. آمیکاسین، جنتامایسین، نتلیمایسین و توبرامایسین بدلیل فعالیت ضد سودوموناسی بهعنوان آمینوگلیکوزیدهای ضد سودوموناسی شناخته شده اند که فعالیت ضد سودوموناس آمیکاسین از همه بیشتر است.
اسپکتینومایسین آمینوگلیکوزید غیرمعمول است. این آنتیبیوتیک بر ضد نایسریا گونورهآ، باکتریوستاتیک است. به نظر میرسد به دلیل فقدان قند آمینی بهعنوان هسته آمینوسیکلیتول، فاقد فعالیت باکتریوسایدی است.
مقاومت باکتریها به آمینوگلیکوزیدها: تأثیر آمینوگلیکوزید مستقیماً به میزان تجمع آن در درون باکتری بستگی دارد. این امر سبب تفاوت آمینوگلیکوزیدها از بتالاکتامها میشود که تأثیرشان به میزان تکثیر باکتری بستگی دارد. آمینوگلیکوزیدها توسط حامل اختصاصی که نیروی خود را از نیروی حرکتی پروتونها (PMF) میگیرد، از غشاء سیتوپلاسمی عبور میکند. انحصاراً باکتریهایی که PMF کم دارند یا فاقد آن هستند، مقاومند. چون بی هوازیها PMF ضعیفی دارند و تخمیرکنندههای اجباری (مثل استرپتوکوکها) فاقد PMF هستند، این باکتریها نمیتوانند، آمینوگلیکوزیدها را وارد خود بکنند و نسبت به آنها مقاومند؛ بنابراین عفونتهای ناشی از بیهوازیها یا استرپتوککها بهطور مؤثر با این آنتیبیوتیکها درمان نمیشوند.
مقاومت اکتسابی به آمینوگلیکوزیدها نیز به دلیل حضور پلاسمیدی (فاکتور R) است که آنزیمهای غیرفعالکننده آمینوگلیکوزیدها را با اتصال یک گروه استیل، فسفات، یا آدنیل به آنها تولید میکند. آنزیم تغییردهنده در غشاء سیتوپلاسم قرار دارد. در طی انتقال آنتیبیوتیک، آنزیم یک گروه به آن چسبانده و آنتیبیوتیک غیرفعال به درون سیتوپلاسم رها میگردد. این امر سبب تأثیر ثانویهای بهصورت انتقال آهسته آنتیبیوتیکها میشود. در غیاب آنزیم تغییردهنده، آمینوگلیکوزیدها فوراً بعد از ورود به باکتری با ریبوزومها واکنش نشان میدهند. اتصال آمینوگلیکوزیدها به ریبوزوم سبب کاهش ظهور آمینوگلیکوزید آزاد در باکتری میشود و سبب تسریع انتقال آمینوگلیکوزید به داخل سلول میگردد. اگر آنزیم تغییردهنده حضور داشته باشد، چون آنتیبیوتیک به ریبوزوم نمیچسبد، پس تسریع در ورود هم دیده نمیشود.
دو نوع مکانیسم کمتر معمول مقاومت دیگر هم برای آمینوگلیکوزیدها توضیح داده شده است؛ در مدل اول، سودوموناس ائروژینوزا و گاهی باکتریهای رودهای دچار تبدیل پلیساکارید صاف به خشن میشوند که توانایی آمینوگلیکوزید برای عبور از غشاء خارجی را بشدت کاهش میدهند. در مدل دوم، انتروکوک (کوکسی گرم مثبت جزء استرپتوککها) و سودوموناس، دچار جهشی در ژن پروتئین S۱۲ میشوند که پروتئین دیگر قدرت تشخیص و اتصال به استرپتومایسین را ندارد.
تتراسایکلینها
ویژگی و مکانیسم عمل: تتراسایکلینها آنتیبیوتیکهای وسیعالطیف باکتریو استاتیکی هستند که بهخوبی در سلول میزبان نفوذ میکنند. این آنتیبیوتیکها، فقط بر ضد باکتریهای سریعالرشد مؤثرند. گروه تتراسایکلین (شکل ۳) شامل تتراسایکلین، کلروتتراسایکلین، دمکلوسایکلین، اکسی تتراسایکلین، داکسی سایکلین و مینوسایکلین هستند که تفاوتشان مربوط به گروه R جانشین موقعیت چهارم هسته مرکزی تتراسایکلین است.
تتراسایکلینها به زیرواحد s ۳۰ ریبوزوم چسبیده و امکان ورود یک آمینوآسیل- tRNA را به سایت A میدهند. آمینوآسیل- tRNA نمیتواند بهصورت پایدار به سایت A متصل شود و طویلسازی پپتید بلوکه میشود.
کاربری و عوارض دارو: تتراسایکلینهای خوراکی قدیمی تمایل زیادی برای کشتن فلور دستگاه گوارش دارند که سبب خلأ باکتریایی در دستگاه گوارش و امکان جانشینی پاتوژنها بجای آنها میشود؛ بنابراین، مصرف تتراسایکلینها سبب کولیت میشود. تتراسایکلینهای نیمه صنعتی (داکسی سایکلین و مینوسایکلین) بیشتر لیپوفیلیک هستند و البته، جذب بیشتر آنها در روده کمتر سبب کولیت میگردد. تتراسایکلین بر روی مغز استخوان اثر میگذارد و مصرف آن در کودکان زیر دوازده سال ممکن است بر روی رشد استخوانی و رنگ دندانها هم اثر بگذارد. در زنان حامله مصرف داخل رگی آنها، ممکن است منجر به نکروز کبد شود.
تتراسایکلین برای درمان اولیه عفونتهای ناشی از باکتریهای داخل سلولی نظیر کلامیدیا ریکتزیا، پنومونی حاصل از مایکوپلاسما پنومونیه و عفونت ادراری ناشی از باسیلهای گرم منفی استفاده میشود. داکسیسایکلین در ترکیب با سایر آنتی بیوتیکها برای درمان اورتریت ناشی از کلامیدیا تراکوماتیس و نایسریا گونورهآ که اغلب یک عفونت مخلوط است، استفاده میگردد. چون تتراسایکلینها از مجاری گوارشی جذب میشوند، مصرف خوراکی دارند. آنها از سد خونی- مغزی عبور نمیکنند، پس در درمان مننژیت مصرف نمیشوند.
مقاومت باکتریها به تتراسایکلین: مقاومت اکتسابی به تتراسایکلینهای چندگانه مثل مینوسایکلین و داکسیسایکلین در باکتریهای گرم منفی گزارش شده و معمولاً هنگامی ایجاد میشود که باکتری، پلاسمید القاکننده سیستم افلوکس فعال را کسب میکند. این سیستم بر روی ورود تتراسایکلینها تأثیری ندارد. تتراسایکلینها بهصورت طبیعی وارد باکتری میشوند، اما در عوض سریعاً به خارج باکتری پمپ میگردند. در باکتریهای رودهای، پنج ژن که این عمل را انجام میدهند، شناسایی شدهاند. اگرچه نوع استاندارد مقاومت به تتراسایکلین افلوکس وابسته به پلاسمید است، اما بعضی از سویههای باکتروئیدس فراژیلیس، نایسریا گونورهآ و استرپتوکک پیوژنز به دلیل جهش ژنهای کروموزومی، کاهشی در اثر تتراسایکلین نشان میدهند.
سایر عوامل ممانعتکننده از سنتز پروتئین
موپیراسین آنتیبیوتیک سودومونیک اسیدی است که با مهار فعالیت سنتز ایزولوسیل- tRNA در باکتریهای حساس، از سنتز پروتئین جلوگیری میکند؛ بنابراین، وقتی که سنتز پروتئین احتیاج به ایزولوسیل- tRNA دارد، این ماده در دسترس نیست و سنتز پروتئین متوقف میشود. موپیراسین باکتریوساید است ولی چون اگر بهصورت سیستمیک مصرف شود، سریعاً متابولیزه میشود، فقط بهصورت پماد تهیه میگردد. موپیراسین بر روی بیشتر استافیلوککها و استرپتوککها، اشریشیا کلی، هموفیلوس انفلوانزا و نایسریا مؤثر است. بهعنوان پماد برای درمان زردزخم (حاصل از استافیلوککها یا استرپتوککها) تجویز میشود و بهصورت داخل بینی برای حذف حاملین استافیلوکک اورئوس استفاده میگردد.
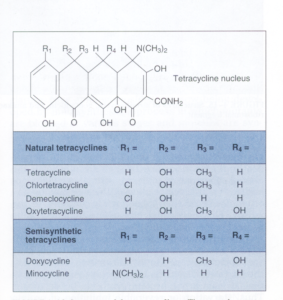
شکل ۳- ساختمان تتراسایکلین
فراپژوهش