مقدمه:
بروسلوزیس یکی از گستردهترین بیماریهای باکتریایی زوئونوز در جهان است که منجر به زیانهای اقتصادی فراوانی در مناطق اندمیک و عوارض جدی در بیماران مبتلا میشود. این عفونت ممکن است از طریق تماس مستقیم با حیوانات منتقل شود، اما معمولاً از طریق مصرف مواد غذایی آلوده با منشأ حیوانی، بهویژه از طریق شیر و پنیر غیرپاستوریزه ایجاد میشود. علاوه بر این، بروسلوزیس شایعترین عفونتهای باکتریایی آزمایشگاهی در سراسر جهان است. اگرچه برنامههای ملی و بینالمللی بسیاری برای ریشهکن کردن پاتوژن و کنترل گسترش آن در دامداری ایجاد شده است، اما بروسلوزیس هنوز یک بیماری نوظهور است. نظارت بر بروسلوزیس حیوانات به علت پایداری باکتریها در حیاتوحش و مخازن زیستمحیطی و انتقال آن به حیوانات خانگی دشوار است.
بروسلوزیس توسط اعضای جنس (Brucella (B ایجاد میشود که کوکوباسیلهای داخل سلولی اختیاری منفرد گرم منفی هستند که از لحاظ تاریخی، با میزبان حیوانی ترجیحی خود، پاتوژنزایی متفاوت و چند ویژگی فنوتیپی افتراق داده میشوند. این جنس شامل شش گونه کلاسیک است:
- melitensisبا ۳ سروتیپ (بهطور عمده از گوسفند و بزها جدا شده است)؛ B. abortus با ۹ سروتیپ (از گاو و دیگر گاوسانان)؛B. suis با ۵ سروتیپ (از خوک، گوزن شمالی و جوندگان کوچک)؛ B. canis (از سگها)؛ B. ovis (از گوسفند) و B. neotomae (از موش صحرایی).
اخیراً، دو گونه جدید از گونههای دریایی، B. pinnipedialis (جدا شده از خوک آبی) و B. ceti (از دلفینها و نهنگها)، B. microti جدا شده از موش صحرائی معمولی و روباه قرمز و B. inopinata جدا شده از زخم ایمپلنت پستان یک بیمار زن ۷۱ ساله شرح داده شدهاند. در گذشته، بسیاری از گونههای غیرمعمول بروسلا بوجود آمدند. این موارد میتوانند گونههای جدید یا گونههای از قبل تعریفشده را نشان دهند؛ بهعنوان مثال، گونههای مختلف بروسلا که از گونههای جوندگان بومی وحشی در شمال کوئیزلند استرالیا ایزوله شدهاند، یک ایزوله جدید بروسلا در ارتباط با دو مورد تولد نوزاد در پریماتهای غیرانسانی و یک سویه مشابه B. inopinata (۲BO) که از بیوپسی ریه یک بیمار ۵۲ ساله استرالیایی مبتلا به پنومونی مزمن جدا شده بود.
آگاهی پزشکان از عفونت در بسیاری از کشورها بسیار ضعیف است و اکثر موارد زمانی بهدرستی تشخیص داده میشود که بیماری از نظر بالینی در مرحله پیشرفته است. به علت تظاهرات بالینی مختلف، بروسلوزیس انسانی میتواند بهآسانی با سایر بیماریهای عفونی و غیر عفونی اشتباه گرفته شود که منجر به تأخیر در تشخیص و در نهایت تأخیر در شروع درمان میشود. جداسازی ارگانیسمهای سخترشد اغلب ناموفق است و یا زمان زیادی طول میکشد، به همین دلیل تشخیص بالینی احتمالی معمولاً با آزمایشهای سرولوژیک تأیید میشود. با این حال، مواردی که از نظر سرولوژیک منفی هستند، واکنش متقابل آنتیبادی ضدبروسلا با بسیاری از باکتریهای بالینی دیگر، باعث ایجاد محدودیتهایی در سیستمهای آزمایشهای سرولوژیکی و غیره میشوند و تفسیر تیترهای اندازهگیریشده را بسیار دشوار مینمایند، لذا امروزه بهجای آن، روشهای مولکولی را میتوان برای تشخیص آزمایشگاهی بروسلوزیس انسان استفاده کرد، اما تشخیص DNA بروسلا، عفونت فعال با باکتریهای زنده را اثبات نمیکند و بنابراین بهطور مؤثر به تصمیمگیری درمانی کمک نمینماید.
اپیدمیولوژی جهانی بروسلوزیس
تقریباً نیم میلیون نفر از موارد بروسلوزیس انسانی سالانه گزارش میشوند، اما این آمارها تعداد کامل افرادی که آلوده هستند را نشان نمیدهد. به علت تشخیص نادرست، بسیاری از موارد شناسایی نمیشوند و بنابراین بهعنوان بیماریهای دیگر یا بهعنوان تب با منشأ ناشناخته، درمان میگردند. با توجه به برآوردهای WHO، شیوع حقیقی ۱۰ تا ۲۵ برابر بیشتر از موارد گزارش شده است. دادههای پایش نشاندهنده یک شکاف کوچکتر بین موارد گزارششده و واقعی هستند، اما تفاوت در این ارقام بهوضوح ناشی از تعریف متغیرها میباشد.
از آنجا که گونههای جدید بهطور مداوم در حال ظهور هستند و در حال حاضر گونههای شناختهشده بروسلا خود را با تغییرات محیطی انطباق میدهند، اپیدمیولوژی بروسلوزیس هنوز مبهم است. از یک طرف، استراتژیهای تشخیصی بهبود یافته و اقدامات فرامرزی برای نظارت بهتر به ریشهکنی و کنترل بیماری در مناطق بومی کمک کرده است. از سوی دیگر، تغییرات در سیستمهای اجتماعی اقتصادی و سیاسی، افزایش جهانی شدن از جمله تجارت بینالمللی حیوانات و گردشگری در سراسر جهان و کاهش آگاهی توسط کارکنان و مقامات بهداشت عمومی منجر به ظهور دوباره کانونهای اندمیک جدید شده است.
در حال حاضر، B. melitensis بهطور عمده علت اصلی بیماری بالینی در انسان در سراسر جهان است، هرچند توزیع بروسلوزیس گوسفند/ بز از لحاظ جغرافیایی محدود است. بروسلوزیس بز/ گوسفند در کشورهای اطراف دریای مدیترانه و خلیج عربی، آسیای مرکزی و بخشهایی از آمریکای لاتین، بهویژه مکزیک، پرو و شمال آرژانتین، شایع است، علاوه بر این، عفونتهای B. melitensis در گوسفند در مناطق جنوب صحرای آفریقا دیده شده است. در ایالات متحده آمریکا، کانادا، شمال اروپا، استرالیا، نیوزیلند و جنوب شرقی آسیا، B. melitensis انزوتیک (بیماری فراگیر در دامها) نیست و تنها موارد تهاجمی تکگیر گزارش شده است. در کشورهای جنوب اروپا وضعیت اپیدمیولوژیک کمتر مطلوب است و شبهجزیره بالکان هنوز هم یک نقطه مهم است. این مناطق اندمیک احتمالاً یک منبع مهم توزیع بیماری در سراسر اروپا از طریق واردات غیرقانونی مواد غذایی آلوده و گردشگری بینالمللی میباشند. بالاترین میزان بروز سالانه از کشورهای خاورمیانه مانند سوریه، عراق، ایران و عربستان سعودی گزارش شده است.
بروسلوزیس گاوی در کانادا، استرالیا، ژاپن و شمال اروپا با موفقیت ریشهکنی شده است، درحالیکه B. abortus هنوز هم در میان گاوها در کشورهای جنوب صحرای آفریقا شایع است. سوئد، دانمارک، فنلاند، آلمان، انگلستان (به استثنای ایرلند شمالی)، اتریش، هلند، بلژیک، لوکزامبورگ و اتحادیه اروپا عاری از بروسلوزیس بودند. نروژ و سوئیس نیز عاری از بروسلوزیس گاو و گوسفند/ بز در نظر گرفته شدهاند.
برنامههای نظارت ملی بر میزان شیوع بروسلوزیس خوکی در احشام کم است، اما شیوع آن در مزارع پرورش خوک در بیشتر مناطقی که خوکها در خارج از منزل نگهداری میشوند، مشاهده میشود. در آسیا، آمریکای جنوبی (عمدتاً در آرژانتین)، ایالتهای جنوب شرقی ایالات متحده و در کوئینزلند استرالیا، پاتوژنهای انسانی بیوارهای ۱ و ۳ بروسلا سویس از گراز وحشی، خوکهای وحشی و خوکهای اهلی جدا شدهاند.
در اروپا، بروسلا سویس بیوار ۲ بیشترین بیوار جداشده در بروسلوزیس خوکی است، اما بهعنوان تنها عامل استثنایی ایجادکننده بروسلوزیس انسان شرح داده شده است. هیچکدام از گونههای بروسلای پاتوژن انسانی که در بالا ذکر شد، در سطح جهانی کنترل نشده و یا از بین نرفتهاند. بروسلوزیس هنوز یک بیماری در حال ظهور در سطح منطقه است و بهراحتی مشمول کنترلهای مرزی نمیشود.
تظاهرات بالینی و درمان بروسلوزیس انسانی
بروسلوزیس انسانی با تظاهرات بالینی مختلف مشخص میشود و تقریباً هر ارگانی میتواند تحت تأثیر قرار گیرد. اختلالات پوستی، هماتولوژیک، گوارشی، تنفسی، استئوآرتیکولار، قلب و عروق و اختلالات نورولوژیکی ممکن است رخ دهد. پس از دوره انکوباسیون که از چند هفته تا چند ماه متغیر است، عفونت حاد معمولاً بهصورت یک بیماری آنفلوانزامانند تبدار بروز مییابد. از آنجایی که تب ممکن است افزایش و کاهش یابد، بروسلوزیس انسانی قبلاً به نام “تب مواج” نامگذاری شده است. به دلیل طیف گستردهای از علائم بالینی آن، بروسلوزیس شبیه بسیاری از بیماریهای غیرعفونی است و بنابراین تشخیص بالینی و آزمایشگاهی اغلب با تأخیر یا عدم تشخیص همراه است. بیماران مبتلا به بروسلوزیس در ابتدا از سردرد، آرترالژی و درد عضله، خستگی، بیقراری، کاهش وزن، لرز و عرق رنج میبرند.
مرحله حاد بیماری معمولاً با باکتریمی و گسترش بروسلا به سیستمهای مختلف بدن، بهطور عمده بافتهای رتیکولواندوتلیالی، بهعنوان مثال، سیستم هماتوپوئیتیک، کبد، طحال و اسکلتی همراه است. متعاقباً، یافتههای بالینی اصلی شامل هپاتومگالی و اسپلنومگالی میباشد. از آنجا که بروسلا قادر به زنده ماندن و تکثیر در سلولهای فاگوسیتیک تکهستهای است، بروسلوزیس انسانی اغلب با عوارض موضعی، دورههای طولانی مدت و مزمن، نارساییهای اولیه درمان و عود بیماری شناخته میشود.
درگیری استئوارتیکولار، بهعنوان مثال اسپوندیلیت، ساکرویلییت و آرتریت، بهعنوان شایعترین عارضه موضعی شناخته شدهاند. آندوکاردیت و بروسلوزیس عصبی مسئول اکثریت موارد مرگومیر هستند. اگرچه این عوارض موضعی میتواند تهدیدکننده زندگی باشد، اما میزان مرگومیر ناشی از بروسلوزیس انسانی پایین است (۱٪).
بروسلوزیس یک بیماری عفونی قابل پیشگیری و درمان است. هدف اصلی از درمان مناسب آنتیبیوتیکی، کاهش روند طبیعی بیماری علامتدار، کاهش میزان بروز عوارض و پیشگیری از عود مجدد است. با این حال، علائم مختلف بالینی اغلب منجر به تشخیص اشتباه یا تأخیر در تشخیص میشود که هر دو، عارضه و میزان مرگومیر را افزایش میدهند.
گرچه مقاومت دارویی جدی در ایزولههای بروسلا هنوز مشاهده نشده است، اما تک درمان یا درمان آنتیبیوتیکی کوتاه مدت، هیچیک برای درمان بروسلوزیس انسانی کافی نیست. کاربرد طولانی مدت داروهای آنتیبیوتیک بهطور مداوم خطر ابتلا به نارسایی اولیه و عود را کاهش میدهد. بهطور خاص، بیماران مبتلا به بیماری موضعی مانند اندوکاردیت یا اسپوندیلیت ممکن است نیاز به درمان طولانی مدت آنتیبیوتیکی و مداخلات جراحی اضافی داشته باشند
رژیمهای آنتیبیوتیکی که بهطور گسترده استفاده شدهاند شامل داکسیسیکلین خوراکی (DOX) به اندازه ۱۰۰میلیگرم دو بار در روز همراه با ریفامپین (RIF) ۶۰۰-۹۰۰ میلیگرم در روز در یک دوز خوراکی یکبار طی یک دوره ۶ هفتهای است. بهجای ریفامپین، استرپتومایسین (STR) ۱ گرم (۱۵ میلیگرم/ کیلوگرم در روز) میتواند بهصورت عضلانی یکبار در روز به مدت ۳-۲ هفته تزریق شود. آمینوگلیکوزید استرپتومایسین را میتوان با استفاده از جنتامایسین (GENTA) در رژیمهای چند دارویی برای بروسلوزیس بدون از دست دادن کارایی، جایگزین کرد، اگرچه میزان شکست کلی (بهطور عمده به علت میزان عود بالا) در بیماران تحت درمان با DOX-RIF در مقایسه با DOX-STR (خطر نسبی ۲/۸۰) [۹۵٪ CI: و ۴/۳۶-۱/۸۱[(۱۳ مورد) بیشتر است. اولین مورد درمان که در بالا ذکر شد، بهعنوان اولین خط درمانی در بروسلوزیس انسان توصیه میشود. دلایل اصلی برای ترجیح رژیم DOX-RIF، مصرف خوراکی و اثرات جانبی کمتر است. ترکیبات سهگانه شامل DOX، RIF و GENTA اثربخشی بیشتری نسبت به DOX با آمینوگلیکوزید داشتند، با این حال، درمان سهگانه باید بهطور جدی مورد ارزیابی قرار گیرد، بهویژه برای بیماران مبتلا به بیماری حاد بدون عوارض موضعی. در درمان کودکان کمتر از ۸ سال، تتراسیکلین منع مصرف دارد و باید با استفاده از تریمتوپریم سولفامتوکسازول (TMP-SMX، کوتریموکسازول) در رژیمهای دارویی دوگانه جایگزین شود. در شرایط استثنایی، TMP-SMX ممکن است بهصورت منوتراپی برای مدت زمان طولانی (تا ۶ ماه) مورد استفاده قرار گیرد. در عمل بالینی، رژیمهای توصیهشده نمیتوانند بهطور کلی مورد استفاده قرار گیرند، بلکه باید برای هر فرد جداگانه تجویز شوند. رمز درمان موفقیتآمیز، ادامه درمان آنتیبیوتیکی و ماهیت رژیم خاص است. مقایسه رژیمهای مختلف آنتیبیوتیکی در درمان بروسلوزیس انسانی دشوار است، زیرا آزمایشهای بالینی دوسرکور، کنترلشده با دارونما و آزمایشهای بالینی چندمرکزی هنوز در دسترس نیستند، همچنین بیماران، بهوضوح تعریف نشدهاند.
بهطور خاص معیارهای تشخیصی برای تشخیص بیماری و درمان موفق بسیار متغیر است، از این رو بیماران مبتلا به بروسلوزیس ممکن است شامل افرادی باشند که بیماری آنها با کشت تأیید شده باشد. مواردی که تیتر آنتیبادی ضد بروسلا در آنها قابلتوجه است، افزایش قابلتوجه در تیتر یا Seroconversion در چندین آزمایش سرولوژیکی دارند، مواردی مبتنی بر تشخیص DNA بروسلا در خون، بافتها و مایعات بدن می باشند و یا حتی مواردی منفی از لحاظ سرولوژیکی ولی از نظر بالینی مثبت هستند.
جداسازی و شناسایی گونههای بروسلا از نمونههای بالینی
تشخیص قطعی بروسلوزیس انسانی مستلزم جداسازی عامل اتیولوژی از خون، مغز استخوان یا سایر بافتهای بدن است. میزان ایزولاسیون باکتری بسته به مرحله بیماری، استفاده قبلی از آنتیبیوتیکها، نمونه بالینی و روشهای کشت متغیر است. از آنجا که تعداد باکتریهای موجود در خون بیماران مبتلا به بروسلوزیس پایین است، جداسازی موفقیتآمیز بروسلا بسیار وابسته به حجم کل نمونه است. زمان جداسازی با غلظت ارگانیسمهای زنده در نمونه خون ارتباط عکس دارد، ازاینرو چندبار نمونهگیری از خون در موارد بروسلوزیس حاد و مواد نمونهبرداری از نقاط آلوده در بیماران مبتلا به عوارض موضعی ممکن است به تأیید عفونت فعال از طریق جداسازی باکتری کمک کند. باکتریمی یک رویداد اولیه در پاتوژنز عفونتهای بروسلا است و میزان جداسازی در موارد حاد بیماری با علائم کمتر از ۲ هفته، بیشتر است. از آنجایی که بیماران باکتریمی نسبت به بیماران فاقد باکتریمی بیشتر در معرض تب و لرز هستند، میزان جداسازی بروسلا از نمونههای خون گرفته شده در فاز تبدار افزایش مییابد. در موارد بروسلوزیس حاد، حساسیت کشت گونههای بروسلا از خون ممکن است از ۸۰ تا ۹۰ درصد متغیر باشد، درحالیکه در موارد مزمن، تأیید باکتریولوژیکال کمتر موفقیتآمیز است و بسته به تکنیک مورد استفاده از ۳۰ تا ۷۰ درصد متفاوت است، از اینرو بازیابی موفقیتآمیز بروسلا از نمونههای خون به مرحله بیماری و تکنیکهای کشت بستگی دارد. در کشورهای توسعهیافته غیراندمیک، تشخیص اغلب با وجود تکنولوژیهای مدرن و مناسب با شکست مواجه میشود، زیرا دورههای مزمن به دلیل عدم وجود ظن بالینی اتفاق میافتند، درحالیکه در کشورهای اندمیک به دلیل کمبود امکانات آزمایشگاهی، تشخیص با شکست مواجه میشود.
با استفاده از کشت مغز استخوان بهجای کشت خون، میزان جداسازی در هر مرحله از بیماری افزایش مییابد (جدول ۱) و میانگین زمان تشخیص بهطور قابلملاحظهای کوتاه میشود. در بیمارانی که قبل از مصرف آنتیبیوتیک مورد آزمایش قرار گرفتند، کشت مغز استخوان همچنین در شناسایی گونههای بروسلا حساستر است. اگرچه آسپیراسیون مغز استخوان و بیوپسی ممکن است دردناک باشد، این روش در موارد خاص مانند بیمارانی که از لحاظ سرولوژیک منفی هستند و به تب با منشأ ناشناخته مبتلا هستند؛ در صورتی که به بروسلوزیس به علت تاریخچه پزشکی و تظاهرات بالینی بیمار مشکوک باشند، ممکن است ارزش داشته باشد.
گونههای بروسلا در اکثر محیطهای استاندارد رشد میکنند، مثلاً آگار خوندار، شکلات آگار، تریپتیکاز سوی آگار و سرم-دکستروز آگار. سرم گاو یا اسب (۵-۲٪) که برای رشد سویههای مختلف موردنیاز است، بهطور معمول به محیط اولیه اضافه میشود. کشتهای خون باید در دمای ۳۵ تا ۳۷ درجه سلسیوس در اتمسفر با ۱۰ تا ۱۰ درصد ۲ CO انکوبه شود. از آنجایی که جداسازی بروسلا از نمونههای بالینی تحت تاثیر رشد آهسته آنها قرار میگیرد کشت ارگانیسمهای سخترشد ممکن است چندین روز یا حتی تا هفتهای قبل از اینکه کلنیهای بدون پیگمان، ریز و فاقد همولیز بروسلا ظاهر شود، طول بکشد. کلنیهای بروسلا صاف، برجسته، محدب، دایرهای، شفاف با قطر ۱-۰/۵ میلیمتر هستند. گونههای بروسلا، اکسیداز و اورهآز مثبت، بسیار کوچک و کوکوباسیل هستند و در رنگآمیزی گرم بهصورت رنگپریده میباشند و در زیر میکروسکوپ به شکل ” ماسه ریز” دیده میشوند.
برای به حداکثر رساندن میزان بازیابی از نمونههای بالینی، روشهای کشت برای کشت بهطور سنتی برای غنیسازی اولیه مورد استفاده قرار میگیرند، دورههای انکوباسیون در موارد احتمالی طولانی هستند و بهطور مرتب انجام میشوند، با این حال، درمان آنتیبیوتیک قبلی در بیماران تبدار، ممکن است از جدا کردن بروسلا از نمونههای بالینی؛ بهخصوص از مایعات استریل بدن که در آن میزان باکتری تلقیح شده اغلب کم است، جلوگیری کند یا آن را با تأخیر مواجه نماید.
در دهههای گذشته، پیشرفتهای مختلف تکنیکی (بهعنوان مثال، روش کاستاندا دوفازی، سیستمهای خودکار و روشهای بهینهسازی عملکرد مانند لیز با سانتریفیوژ) بهتدریج حساسیت روشهای کشت را افزایش داده و بهطور قابلملاحظهای زمان را برای شناسایی گونههای بروسلا در نمونههای بالینی کوتاهتر کرده است.
جدول ۱: عملکرد تشخیصی تکنیکهای کشت، آزمایشهای سرولوژیکی و روشهای مولکولی در تشخیص آزمایشگاهی بروسلوزیس انسانی بسته به مرحله بیماری
| عملکرد تشخیصی بسته به مرحله بیماری (طول علائم بالینی) (٪) |
| ||||||||||
| عود | بروسلوزیس مزمن
(≥۵۲ هفته) | بروسلوزیس تحت حاد
(۵۲-۸ هفته) | بروسلوزیس حاد (≤۸ هفته) | ||||||||
| کشت خون کامل | |||||||||||
| ۰٫۰ | ۲۳٫۵ | ۶۶٫۶ | بروسلا براث و سابکالچر | ||||||||
| ۸٫۳ | ۱۱٫۰ | ۴۱٫۷ | ۴۲٫۳ | محیط دوفازی کاستاندا | |||||||
| ۲۸٫۶ | ۳۶٫۴ | ۵۴٫۷ | محیط دوفازی کاستاندا | ||||||||
| ۳۳٫۳ | ۷۱٫۸ | محیط دوفازی کاستاندا | |||||||||
| ۲۵٫۰ | ۴۰٫۰ | ۸۳٫۳ | محیط دوفازی کاستاندا | ||||||||
| ۱۶٫۶ | ۲۲٫۲ | ۵۸٫۳ | ۴۸٫۱ | لیز با سانتریفیوژ | |||||||
| ۷۴٫۱ | ۹۰٫۹ | لیز با سانتریفیوژ | |||||||||
| کشت مغز استخوان | |||||||||||
| ۳۳٫۰ | ۵۲٫۰ | ۸۳٫۳ | بروسلا براث و سابکالچر | ||||||||
| ۵۰٫۰ | ۹۰٫۰ | ۹۷٫۲ | محیط دوفازی کاستاندا | ||||||||
| ۶۴٫۳ | ۷۲٫۷ | ۹۲٫۲ | محیط دوفازی کاستاندا | ||||||||
| سرولوژی | |||||||||||
| ۷۵٫۰ | ۷۰٫۰ | ۹۱٫۷ | آگلوتیناسیون لوله | ||||||||
| ۲۷٫۵ | ۵۰٫۰ | ۲۱٫۰ | آگلوتیناسیون سرم | ||||||||
| ۸۲٫۷ | ۶۶٫۶ | ۴۹٫۱ | تجاری IgM- و IgG-ELISA | ||||||||
| تشخیص مولکولی | |||||||||||
| ۱۰۰ | ۱۰۰ | Real-time quantitative PCR | |||||||||
روش کاستاندای دوفازی کلاسیک که بر اساس یک فاز جامد و مایع در یک بطری یکسان کشت خون است، نیاز به سابکالچرهای مکرر را از بین میبرد، با این حال، زمان بازیابی بروسلا از خون هنوز میتواند تا ۳۰ روز طول بکشد. در مقابل، سیستمهای کشت خون بهطور قابلتوجهی زمان را برای تشخیص کاهش میدهد. ازاینرو، عامل بیماری میتواند از خون بیماران آلوده در طی ۴ روز با استفاده از روشهای
BACTEC™ (Becton Dickinson Diagnostic Systems, Sparks, MD, USA) یا BacT/Alert™ (bioMérieux Inc., Durham, NC, USA) جدا شود که بهطور مداوم آزاد شدن ۲ CO از میکروارگانیسمهای در حال رشد را کنترل میکنند. علاوه بر این، میزان بازیابی میکروارگانیسمهای بیماریزا شامل گونههای بروسلا از مایعات استریل بدن با استفاده از سیستمهای کشت خون اتوماتیک بالاتر است. علیرغم عملکرد بهتر سیستمهای کشت خودکار در مقایسه با محیط کشت جامد و سیستمهای نیمه اتوماتیک، دوره انکوباسیون طولانی مدت و سابکالچرهای دورهای حداقل ۴ هفتهای، هنوز بهطور قابل اعتماد برای جلوگیری از عفونت بروسلا توصیه میگردد. غنیسازی باکتریها با استفاده از تکنیک کشت لخته خون یا لیز با سانتریفیوژ باعث افزایش میزان جداسازی بروسلا از نمونههای خون میشود.
روش لیز با سانتریفیوژ، بالاترین عملکرد را در بین ، بالاترین محصول را در بین تکنیکهای غنیسازی باکتریها جهت کشت نشان میدهد (جدول ۱) و میانگین زمان تشخیص در خون و مایعات استریل بدن میتواند بهطور معنیداری به چند روز کاهش یابد. با استفاده از لیز با سانتریفیوژ، متوسط زمان تشخیص از ۲ تا ۳ روز متغیر است و بیشتر جدایههای بروسلا قبل از رشد باکتری در کشتهای مرسوم ایزوله میشونـــد. سیستم BACTEC Myco / F-Lytic بهطور موفقیتآمیز، فعالیت لیتیک و اتوماتیک بودن را ترکیب میکند.
اگر تعداد بروسلای قابل کشت بسیار کم باشد، بهعنوان مثال در نمونههای بالینی ماننــــــــــــد چرک، Shell vial culture ممکن است یک روش جایگزین باشد که امکان جدا شدن پاتوژنهای داخل سلولی اختیاری را فراهم میآورد. کلنیهایی که مشکوک به گونههای بروسلا هستند را میتوان با استفاده از تست آگلوتیناسیون اسلایدی با استفاده از آنتیسرم پلیوالانت رقیقنشده بروسلا (سرم ضدS) همراه با سوسپانسیون تهیهشده از کلنیها در سالین تأیید کرد. شناسایی بیشتر گونههای بروسلا و بیوارها معمولاً بر اساس نیاز به ۲CO، تولید H۲S، فعالیت اوره، آگلوتیناسین با سرم (A و M)، مهار رشد انتخابی بر روی محیط حاوی رنگ مانند تیونین یا فوشین بازی و فاژ تایپینگ است. از آنجا که این روشها زمانگیر، خطرناک و تفسیر آنها متغیر است، برای آزمایشگاههای میکروبیولوژیکی بالینی مناسب نیستند. با استفاده از آزمایشهای بیوشیمیایی تجاری موجود مانند API ۲۰ NE® (bioMérieux, Nürtingen, Germany)، گونههای بروسلا ممکن اســت با Psychrobacter phenylpyruvicus (که قبلاً Moraxella phenylpyruvica نامیــده میشد) یا Ochrobactrum anthropi اشتباه شوند و منجر به تشخیص اشتباه گردند. اخیراً یک سیستم نیمه اتوماتیک بیوتایپ متابولیک (Micronaut ™، Merlin Diagnostika، Bornheim-Hersel، Germany) بر اساس انتخاب ۹۳ سوبسترای مختلف برای شناسایی بروسلا و تمایز گونهها و بیوارهای آن ارائه شده است. این فنآوری جدید ممکن است جایگزین یا حداقل تکمیلکننده آزمایشهای زمانبر لولهای، بخصوص در مورد سویههای غیرمعمول شود، با این حال، تعیین زیرتیپ گونههای بروسلا برای تصمیمگیری در مورد اقدامات درمانی ضروری نیست. در مقابل، شناسایی سریع جنس بروسلا برای شروع درمان آنتیبیوتیک در ابتدای بیماری بسیار مهم است، بنابراین از دورههای مزمن و عوارض موضعی جلوگیری میشود. توسعه تکنیکهای تشخیصی جدید که به تشخیص سریع بروسلا از کشت کمک میکنند و خطر عفونتهای آزمایشگاهی را به حداقل میرسانند، اهمیت زیادی دارند. تست اورهآز مستقیم بر روی کشت مثبت خون که نشاندهنده وجود بروسلا است، میتواند تشخیص احتمالی بروسلوزیس انسان و تشخیص باکتریمی بروسلا را با وجود آلودگیهای موجود در سلولهای خون، تسریع نماید. (Fluorescence in situ hybridization (FISH که از پروبهای مختص بروسلا استفاده میکند نیز یک ابزار ارزشمند برای شناسایی جدایههای کشتشده و برای تشخیص مستقیم بروسلا در کشت مثبت خون است، ازاینرو، بدون نیاز به سابکالچر و تستهای فنوتیپی، باکتریها میتوانند بهسرعت شناسایی شوند. روش جدید جریان جانبی بر مبنای تبدیل فسفر، بهصورت کمی، بروسلا را از هر دو کشت خالص و نمونههای بافتی شناسایی کرد. بهتازگی ثابت شده است که طیفسنجی جرمی واجذبی/یونشی لیزری به کمک ماتریس و طیفسنج جرمی جذب- یونیزاسیون لیزری سطحی ارتقاءیافته در شناسایی مستقیم اعضای جنس بروسلا از پلیتهای کشت و بطریهای کشت خون سودمند است، با این حال، پایگاههای جامعی از جمله مشخصات پروتئینی گونههای بروسلا در دسترس نیستند که در حال حاضر استفاده از این فناوریهای جدید را در آزمایشگاههای میکروبیولوژی بالینی محدود میکند. باکتریهایی که در طی عود بیماری جدا شدهاند الگوی حساسیتی ضدمیکروبی مشابه ایزولههایی که از اولین واقعه بروز بیماری بهدست میآید را نشان میدهند و بیشتر موارد عود بهخوبی به یک دوره تکراری از درمان استاندارد آنتیبیوتیک پاسخ میدهند، ازاینرو، مقاومت به داروهای آنتیبیوتیکی اساساً به شکست و عود بیماری کمک نمیکند و اهمیت بالینی آزمایشهای تعیین حساسیت در شرایط درونتنی برای بروسلا سؤالبرانگیز است.
تشخیص سرولوژیک در بیماران مبتلا به بروسلوزیس
از آنجا که تکنیکهای کشت زمانگیر، خطرناک و غیرحساس هستند، اکثر پزشکان به اثبات غیرمستقیم عفونتهای بروسلا مبتنی بر افزایش یا بالا رفتن تیترهای آنتیبادیهای خاص متکی هستند. علاوه بر این، آزمایشهای سرولوژیکی نهتنها برای تشخیص اولیه بروسلوزیس انسانی، بلکه برای پیگیری درمان نیز مورد استفاده قرار میگیرند. با این حال، مفید بودن سرولوژی در پیگیری درمان، به میزان کم به اثبات رسیده است.
پروفایلهای آنتیبادی و آزمایشهای سرولوژیکی در طول بیماری
غلبه آنتیبادیهای ایزوتایپ IgM در هفته اول بعد از تلقیح، معمولاً در هفته دوم با تغییر به IgG و افزایش پیوسته در تیتر هر دو سابتایپ که طی ۴ هفته به اوج میرسد، ادامه پیدا میکند. در اوایل این بیماری، آزمایشهای سرولوژیکی میتوانند منفی باشند و بنابراین تستهای آزمایشگاهی باید پس از ۲-۱ هفته در موارد مشکوک بالینی تکرار گردند. انجام پیوسته تستهای سرولوژیک نیز امکان نظارت بر پاسخ درمان را فراهم میکنند. تیتر آنتیبادیها معمولاً پس از شروع درمان مناسب آنتیبیوتیک کاهش مییابد، اما ممکن است نشانههای قابلتوجه برای چند ماه یا حتی سالها، با وجود موفقیت درمانی و کشت خون منفی، ادامه یابد. این واقعیت، تمایز بین عفونت فعال و سابقه بروسلوزیس یا حافظه ایمنی بدون ارتباط بالینی مانند مواجهه مجدد با عامل مسبب را پیچیده میکند، در نتیجه، تیترهای افزایشیافته ممکن است منجر به درمان آنتیبیوتیکی درازمدت غیرضروری شوند. با توجه به فقدان معیارهای تشخیصی آزمایشگاهی برای درمان قطعی، تیترهای آنتیبادی پایدار در طول پیگیری برای تفسیر دشوار است. بیماران مبتلا به بیماری فعال نمیتوانند بهراحتی از افرادی که در گذشته به بروسلوزیس مبتلا بودهاند، با نتایج آزمایشهای سرولوژیکی، تمایز داده شوند. از یک طرف، شناسایی تنهای آنتیبادی ضد بروسلا شواهدی برای حضور پاتوژن ارائه نمیدهد؛ از طرف دیگر، در طی مراحل بعد از درمان، تیترهای بالا اغلب در ارتباط با تیترهای بالا در طول مرحله بیماری اولیه هستند و همیشه نشانهای از نارسایی اولیه درمان، بیماری مزمن یا عود نیستند. بهخصوص در مناطق اندمیک، بخش بزرگی از جمعیت ممکن است دارای آنتیبادیهای اختصاصی پایدار به دلیل مواجهه مداوم با بروسلا باشند. ارزیابی سابقه شیوع در افراد سالم بهمنظور تعیین مقادیر Cut off برای روشهای سرولوژیک در مناطق آندمیک و غیراندمیک مهم است. کاهش سریع آنتیبادی IgG یک شاخص پیشآگهی برای درمان موفق است، درحالیکه تیتر IgG بالا بهصورت پایدار بعد از درمان میتواند نشانهای از بیماری فعال باشد. تیتر آنتیبادی در بیماران مبتلا به عوارض موضعی آهسته کاهش مییابد و عود با اوج ثانویه IgG و IgA ضد بروسلا، اما نه ایمونوگلوبولین M مشخص میشود. پاسخ سرولوژیک در طی دوره بروسلوزیس عمدتاً بر اساس آنتیبادیهایی است که بهطور مستقیم علیه لیپوپلیساکارید صاف (s-LPS) تولید میشوند. اکثر آزمایشهای سرولوژیک کلاسیک همراه با ELISA قابل دسترس، از عصارههای باکتریایی حاوی غلظتهای بالا s-LPS استفاده میکنند و به همین ترتیب تشخیص قابل اطمینان آنتیبادیهای آگلوتینین و / یا غیر آگلوتینین را امکانپذیر میکند. از آنجایی که اپیتوپ غالب ایمنی زنجیره O پلیساکاریدی بروسلا شبــــیه به باکتریهای مختلفی مانند Yersinia enterocolitica O: ۹، سالمونلا اوربانا گروه N، Vibrio cholerae، Francisella tularensis، Escherichia coli O: ۱۵۷ و Stenotrophomonas maltophilia است، واکنش متقاطع ممکن است رخ دهد که بنا بر همین عامل، اختصاصیت آزمایشهای مبتنی بر LPS میتواند کم گردد.
در بیمارانی که دارای علائم بالینی مشابه با بروسلوزیس هستند و یک پیشزمینه اپیدمیولوژیک مطابق با بروسلوزیس دارند و یا نتایج آزمون سرولوژیک با استفاده از روشهای استاندارد مبتنی بر آنتیژنهای صاف بروسلا نامشخص است، باید از بروسلوزیس سگی صرفنظر کرد. تشخیص سرولوژیک بروسلوزیس سگی نیاز به آمادهسازی آنتیژن خاص دارد، زیرا گونههای B. canis آنتیژن LPS با واکنش متقابل با سایر گونههای بروسلا را ندارند. از آنجایی که هنوز آنتیژن استاندارد مرجع مورد استفاده در آزمایشهای سرولوژیکی وجود ندارد، آمادهسازی آنتیژن میتواند بر تشخیص سرولوژیک بروسلوزیس انسانی تأثیر بگذارد. روشهای سرولوژیک متعددی برای شناسایی آنتیبادیهای بروسلوزیس در دسترس هستند. قبلاً جزئیات تکنیکی تستهای سرولوژیکی فعلی در تشخیص بروسلوزیس انسانی توصیف شدهاند. بیشترین آزمایشهای سرولوژیک در تشخیص بروسلوزیس انسانی، آزمون آگلوتیناسیون سرم (SAT)، آزمون رز بنگال (RBT)، آزمایش کومبس (CT) و ELISA است. با توجــه به دقــت کلی آنــها در شـــرایط بالینــــی، این تستها میتوانند بهصورت ELISA> RBT> SAT> CT رتبهبندی شوند. آزمون ثبوت مکمل که بهطور گستردهای بهعنوان یک تست تأیید برای تشخیص سرولوژیک بروسلوزیس حیوانی مورد استفاده قرار میگیرد، برای تشخیص بیماریهای انسانی در آزمایشگاههای بالینی غالباً استفاده نمیشود. تجربه خوبی در استفاده از آزمایش پلاریزه نمودن فلورسانس در تشخیص آزمایشگاهی بروسلوزیس انسانی وجود دارد، درحالیکه این آزمایش برای نظارت بر بروسلوزیس حیوانات بهطور گستردهای مورد استفاده قرار گرفته است.
آزمایش SAT، RBT و جریان جانبی
SAT بهعنوان روش مرجع در تشخیص سرولوژیک بروسلوزیس شناخته شده است، با این حال، تست آگلوتیناسیون لوله کلاسیک (آزمایش رایت) پرکار و زمانبر است و کاربرد آن در آزمایشگاههای معمول که با نمونههای خون سروکار دارند را با دشواری روبهرو میکند. فرمتهای عملی از این روش عبارتند از روش اسلایدی، پلیت و کارد آگلوتیناسیون.
در کشورهای اندمیک، RBT که یک آزمون کارد (با استفاده از سوسپانسیون آنتیژن محلول بروسلا آبورتوس
سویه ۱۱۱۹-۳ USDA که (۸٪) رنگآمیزی شده با رنگ رز بنگال بافری با pH ۳,۶۵ ± ۰٫۰۵ است، بهطور سنتی بهعنوان آزمون سریع غربالگری در اورژانس مورد استفاده قرار گرفته است. آزمون تشخیصی RBT در بیماران بدون مواجهه قبلی با بروسلا یا سابقه بروسلوزیس عالی است، اما در بیمارانی که بهطور مکرر در معرض عوامل اتیولوژیک قرار گرفتهاند یا در گذشته سابقه ابتلا داشتند، ضعیف است، بنابراین RBT نیاز به تأیید با یک آزمون اختصاصیتر مانند ELISA دارد. به همین ترتیب، تیتر سرمهای رقیقشده برای تست RBT ممکن است به شناسایی درست بیماران در یک جمعیت با خطر بالا با احتمال مواجهه قبلی کمک کند. در کشورهای غیراندمیک، ویژگی تستهای تشخیصی کمتر با نگرانی همراه است، زیرا برای پیگیری و ارزیابی مجدد تیتر مثبت پایین که ممکن است بهصورت «عدم تشخیص» گزارش شود، میتوان بهآسانی سرم تهیه کرد.
علاوه بر این، یک احتمال بالقوه پیشآزمون بر اساس علائم بالینی نیز ممکن است احتمال نتیجه آزمایش سرولوژیک مثبت را در بیماران مبتلا به بروسلوزیس مشکوک افزایش دهد. اگرچه تفسیر SAT و RBT تا حد زیادی تحت تأثیر تجربه کارشناس است، نتایج آزمایش بین آزمایشگاههای مختلف و سایر آزمونهای سرولوژیکی هم قابلتوجه است. یک روش جایگزین آسان برای انجام آزمایش سریع در مزرعه و در مناطق روستایی فقیر که به آزمایشگاههای مجهز دسترسی ندارند، آزمایش جریان جانبی است. ثابت شده است که آزمایش جریان جانبی بروسلا در شناسایی سطوح پایین آنتیبادیهای IgG یا IgM خاص نسبت به SAT حساسیت بیشتری دارد. تیترهای≥ ۱:۱۶۰ روش SAT اگر با یک دوره بالینی سازگار در بیماران با سابقه مواجهه با عامل بیماری همراه باشد، بهطور کلی بروسلوزیس فعال در نظر گرفته میشود. با این حال، مقادیر cut off برای تیترهای مربوطه در آزمایشهای آگلوتیناسیون هنوز هم بحثبرانگیز است. شیوع بالای آنتیبادیهای بروسلا در جمعیت سالم، اختصاصیت را کاهش میدهد و تیترهای ≥۱:۳۲۰ ممکن است در مناطق اندمیک اختصاصیتر باشند. SAT دارای موارد منفی کاذب در موارد پیچیده و مزمن است. در دوره اولیه بیماری، حتی بیمارهای دارای باکتریمی با تیتر ≤۱: ۱۶۰ ممکن است وجود داشته باشد. افزایش چهار برابر یا بیشتر در تیتر آگلوتیناسیون بروسلا بین نمونههای سرم در فاز حاد و نقاهت که به فاصله حداقل دو هفته تهیه میشوند، ممکن است عفونت را اثبات کند، بنابراین تنها یک تیتر آگلوتیناسیون ≤۱: ۱۶۰ نمیتواند از نظر تشخیصی دارای اهمیت باشد و بعضی از موارد بروسلوزیس که در مرحله حاد بیماری از لحاظ سرمی منفی هستند، ممکن است بدون آزمایش سرولوژی سرم جفتشده و یا انجام بیش از یک آزمون سرولوژیکی نادیده گرفته شود. ترکیبی از آزمایشهای مختلف سرولوژیکی از جمله روشهای مختلف آزمایش ممکن است به ارزیابی عملکرد کیفی کمک کند، زیرا میتوان از نتایج منفی کاذب ناشی از کم بودن کیفیت آنتیژن یا استانداردهای تکنیکی ضعیف جلوگیری کرد. درمان قطعی یک بیمار بهخوبی با تیترهای پایین SAT همبستگی دارد، بنابراین بیماران مبتلا به بروسلوزیس باید از نظر بالینی و سرولوژیک پیگیری شوند. با این وجود، دورههای پیگیری پیشرفته سرولوژی ممکن است در بیمارانی که از لحاظ بالینی خوب هستند، معقول نباشد. تیترهای قابلتوجه SAT در ۳ تا ۵ درصد موارد بروسلوزیس بالینی درمان شده دو سال پس از درمان موفق آنتیبیوتیکی مشاهده شده است و این اعداد ممکن است در جمعیتهای مختلف حتی بعد از یک رژیم آنتیبیوتیکی دیگر، با استفاده از سایر آزمایشهای سرولوژیکی و غیره بالاتر باشد.
آزمون کومبس و بروسلاکاپت
آزمون کومبس کلاسیک بیشتر بهعنوان یک روش توسعهیافته از SAT برای تشخیص آنتیبادیهای ناقص، مسدودکننده یا غیرانعقادی استفاده میشود. این تست برای تشخیص تغییرات جزئی در تیترهای آنتیبادی ضد بروسلا در دورههای مزمن و در طی عود بیماری مناسبترین آزمون سرولوژیکی است. نقص اصلی آزمونهای کلاسیک، مانند SAT و CT این است که آنها پـــــــــرکار و وقتگیر هستنـــد. بروســــلاکاپت (Vircell, Santa Fé, Granada, Spain), یک آزمایش تکمرحلهای گیرنده ایمنی برای تشخیص کل آنتیبادی ضد بروسلا و یک جایگزین ارزشمند برای CT است. سادگی Brucellacapt آن را بهعنوان یک آزمون مکمل دوم مناسب ساخته است. بیماران مبتلا به بیماری پایدار بیشتر با علائمی نظیر تیتر بالا در زمان پذیرش و رگرسیون آهستهتر در طی پیگیری مشاهده میشوند و تیتر آنها در بروسلاکاپت هیچگاه به ≤۱:۳۲۰ نمیرسد، بهویژه در موارد عود، تیترهای تعیینشده توسط Brucellacapt و CT بهآرامی کاهش مییابد و در مقایسه با SAT، چندین قله را نشان میدهد. این تغییرات در عود باکتریمی بیشتر مشهود است. کاهش تیترها بعد از درمان موفقیتآمیز و درمان بالینی بیماران در Brucellacapt بیشتر و سریعتر از SAT و CT است، ازاینرو، تیترهای Brucellacapt نشانگر خوبی از فعالیت عفونت است که بهویژه در مورد پیگیری بیماران مفید است. با این حال، در بعضی موارد از عود و بیماری مزمن، تنها تغییرات اندکی در آنتیبادیهای مرتبط مشاهده میشود که با CT بهتر تشخیص داده میشوند.
الایزا
نتایج بدستآمده با استفاده از کیت تجاری ELISA نشان میدهد که این روش مطابقت بسیار خوبی با SAT و CT برای تشخیص آنتیبادیهای بروسلا دارد؛ بنابراین ELISA میتواند بهطور قابل اعتماد در تشخیص بروسلوزیس انسانی مورد استفاده قرار گیرد. بهخصوص در بروسلوزیس مزمن و گذشته، ELISA حساستر از SAT است (جدول ۱). با این حال، در موارد حاد، آزمایشهای آگلوتیناسیون نتایج مشابهی را نشان میدهد و ارزانترند.
ELISA یک روش عالی برای غربالگری سرم برای آنتیبادیهای بروسلا است و تشخیص اولیه تیترهای IgM برای تشخیص بروسلوزیس در اکثر بیماران با علائم، نشاندهنده بیماری حاد کافی است. با این حال، در همه بیماران مبتلا به بروسلوزیس، آنتیبادی IgM نمیتواند بهطور موفقیتآمیز شناسایی شود. نتایج IgM منفی غلط ممکن است به علت اضافه شدن آنتیبادی IgG و نتایج مثبت کاذب به علت وجود عامل فاکتور روماتوئید باشد. ازاینرو، قبل از آزمایش برای آنتیبادی IgM ضد بروسلا، باید روماتوئید فاکتور بهطور معمول از طریق جذب حذف شود تا نتیجه مثبت کاذب را رد کند. اگر تنها یک زیرگروه از ایمونوگلوبولینها با استفاده از ELISA اندازهگیری میشود، بسیاری از بیماران مورد آزمایش منفی کاذب خواهند شد. برای تشخیص قطعی بروسلوزیس انسانی و طبقهبندی مرحله بیماری باید حداقل آنتیبادیهای IgG و IgM تعیین شوند.
تشخیص مولکولی بروسلا در نمونههای بالینی
در تشخیص آزمایشگاهی بروسلوزیس انسانی، ثابت شده است که PCR نسبت به کشت خون حساستر است و از آزمایشهای سرولوژیکی، در بیماریهای حاد و مزمن اختصاصیتر است. علاوه بر این، کار بر روی DNA باعث کاهش خطر ابتلا به عفونتهای آزمایشگاهی به علت عفونتزایی بالای کشتهای زنده میشود. تعداد زیادی از روشهای PCR برای شناسایی مستقیم بروسلاهای کشتشده ایجاد شدهاند و تعدادی از این تکنیکها برای تشخیص بروسلوزیس انسانی ارزشمند است. ژنوم بروسلا در نمونههای بالینی مختلف، از جمله سرم، نمونه خون و نمونههای ادرار، بافتهای مختلف، مایع مغزی نخاعی، مایع سینوویال یا پلور و چرک قابل تشخیص است.
با توجه به دسترسی آسان آنها، نمونههای خون کامل و سرم در حال حاضر برای تشخیص مولکولی بروسلوزیس انسانی مورد ارزیابی قرار میگیرند. اینکه آیا سرم نسبت به کل خون مناسبتر است یا خیر برای تشخیص مولکولی عامل مسبب یا برعکس، هنوز بحثبرانگیز است. غلظت مهارکنندههای PCR در نمونههای سرم پایینتر است، اما تعداد کمتر باکتریهای در گردش خون، بهعنوان مثال در دورههای مزمن یا پس از درمان آنتیبیوتیک، ممکن است منجر به عدم وجود DNA هدف شود که منجر به نتایج منفی کاذب گردد.
از آنجایی که رژیمهای آنتیبیوتیکی مستقل از گونه مسبب بروسلوزیس در انسان هستند، تشخیص بروسلا از طریق PCR ژن خاص برای تشخیص سریع و شروع درمان مناسب است. اگرچه توالیهای مختلف برای شناسایی جنس بروسلا مورد استفاده قرار گرفته است، در شرایط بالینی اکثر آزمایشهای PCR ژن bcsp۳۱ را هدف قرار میدهند که یک پروتئین غشای خارجی ایمونوژنیک–kDa ۳۱ محافظتشده در میان تمام گونههای بروسلا را کد میکند. یک روش مختص جنس که ژن bcsp۳۱ را هدف قرار میدهد برای غربالگری مناسب است، زیرا از نتایج منفی کاذب ناشی از گونههای نادر و بیوارها ممانعت میکنند. با این حال، یک هدف ژن دوم برای تأیید تشخیص اولیه مولکولی ضروری است. استفاده از بیش از یک مارکر مولکولی ممکن است حساسیت و اختصاصیت را افزایش دهد. توالی ژنS rRNA ۱۶ میتواند یک ابزار قابل اعتماد برای شناسایی تأییدی سریع گونههای بروسلا و تمایز آنها از میکروارگانیسمهای مرتبط باشد، علاوه بر این، آزمایشهای مختلف PCR ممکن است امکان نظارت بر گونههای خاص را فراهم کند، برای این منظور اخیراً یک آزمایش PCR چندمنظوره مناسب برای شناسایی انواع گونههای بروسلا و گونههای واکسن
- abortus RB۵۱, B. abortus S۱۹ and B. melitensis Rev۱ صورت گرفته است. در مطالعۀ چندتایی در سراسر جهان، Bruce-ladder PCR ثابت کرده است که برای شناسایی سریع سویههای بروسلا در آزمایشگاههای میکروبیولوژی پایه مفید است. در آزمایشگاههای میکروبیولوژی،Real-time PCR امکان غربالگری سریعتر نمونهها با کارایی بالا و عرضهی نتایج در عرض چند ساعت را فراهم میکنـد. آنالیزهای Real-time PCR اختصاصی جنس، بهطور موفقیتآمیزی برای نمونههای مختلف انسانی انجام شده است. اثرات مهاری در نمونههای بالینی ممکن است رخ دهد، اما یک کنترل تکثیر داخلی میتواند به جلوگیری از مهار PCR کمک نماید. علیرغم حساسیت تحلیلی بالا در آزمایشهای Real-time PCR، تعداد کم باکتری در نمونههای بالینی هنوز در تشخیص مولکولی بروسلوزیس انسانی مشکل ایجاد میکند، بنابراین، روشهای آمادهسازی نمونه اولیه، باید باعث کاهش اثرات مهاری ناشی از اجزای نمونهها شود و همچنین باید DNA را تغلیظ کنند. روش جوشاندن ساده سرم برای استخراج DNA، از مهارکنندههای PCR جلوگیری نمیکند، اما کیتهای تجاری مختلف مانند کیت QIAamp™ DNA Mini Kit (Qiagen Inc., Valencia, CA, USA) و کیت UltraClean™ DNA BloodSpin Kit (MO BIO Laboratories Inc., Carlsbad, CA, USA) با موفقیت برای استخراج DNA بروسلا از نمونههای خون، سرم و بافت مورد استفاده قرار گرفته است. با این حال در حال حاضر، مطالعات ارزیابی جامع در مورد روش استخراج DNA در نمونههای مختلف انسان ناقص هستند. با استفاده از آنالیزهای Real-time PCR بروسلا، حدود پنج باکتری در هر واکنش میتوانند شناسایی شوند. حساسیت را میتوان با آزمایش چندین تکرار DNA خالص به موازات یا با استفاده از المنت ۷۱۱ IS افزایش داد. این عناصر بروسلا بهعنوان یک هدف برای تکثیر در نظر گرفته شده که در نسخههای متعدد در کروموزومهای بروسلا یافت میشوند. در دهه گذشته، بسیاری از مطالعات بالینی برای ارزیابی سودمندی روشهای PCR در طول دوره بیماری بروسلوزیس انسانی با شروع دوره انکوباسیون در طول پیگیری پس از درمان انجام شده است. تشخیص مولکولی کیفی DNA بروسلا عمدتاً بروسلوزیس حاد یا سابقه بیماری را اثبات میکند. پس از شروع درمان با آنتیبیوتیک، مقدار DNA در نمونههای خون بهطور واضح کاهش مییابد که همزمان با ناپدید شدن علائم است، اما بهطور ضعیف در حین پیگیری حتی در بیماران بدون علامت مثبت باقی میماند. در مقایسه با روشهای روتین میکروبی، معیارهای واضح تعریفشده برای ایجاد موفقیت درمان یا پیشبینی عود در روشهای مولکولی وجود ندارد. Real-time PCR کمی یک ابزار ارزشمند در تشخیص اولیه بیماری غیرفعال علامتدار در بیمارانی است که روشهای میکروبیولوژیکی کلاسیک در آنها با شکست مواجه شده است، علاوه بر این، عفونتهای فعال و گذشته بروسلا میتواند متفاوت باشد. در تست PCR معمولی که برای پیگیری اثربخشی درمان انجام میشود، تشخیص DNA بروسلا در نمونههای خون بهعنوان نشانهای از عود بوده، درحالیکه یک نتیجه PCR منفی نشاندهنده نتیجه درمان موفقیتآمیز است. در مقابل، با استفاده از تکنیکهای Real-time PCR، DNA بروسلا در اکثر بیماران مبتلا به بروسلوزیس در طول درمان و پیگیری، علیرغم درمان مناسب آنتیبیوتیکی و بهبود بالینی، تشخیص داده میشود. مقدار DNA باکتریایی پس از پایان درمان بهطور مداوم کاهش مییابد، با این حال، در تعداد قابلتوجهی از بیماران، بروسلای DNA برای چندین ماه یا حتی سالها پس از درمان بالینی قابل تشخیص است و عدم وجود علائم، نشاندهنده بیماری مزمن یا عود بیماری آن است، ازاینرو، پاسخ بالینی به درمان آنتیبیوتیک به نظر نمیرسد با ریشهکنی پاتوژن در بیماران مبتلا به بروسلوزیس معادل باشد، این رویداد ممکن است با بقا و پایداری بروسلا در ماکروفاژهای بدن توضیح داده شود. با توجه بهسرعت پائین تکثیر باکتری، سیستم ایمنی بدن بیمار قادر به کنترل باکتریهای گذرا است. علاوه بر این، آزمایشهای Real-time PCR عملکرد تشخیصی بالاتر از تکنیکهای متداول که منجر به تشخیص حساس میکروارگانیسمها در حالت VBNC یا فاگوسیتوز شده را نشان میدهد. با این حال امکان عود در بیمارانی که DNA بروسلا در آنها شناسایی نشده نیز وجود دارد. مقدار DNA باکتریایی در جریان بیماری اساساً در بیماران مبتلا به عود و افراد بدون عود متفاوت نیست. با این وجود، Real-time PCR ممکن است در تشخیص عفونت مزمن مفید باشد. DNA بروسلا را میتوان در افراد بدون علامت با سابقه بروسلوزیس تشخیص داد، اگرچه به نسبت کمتر از گروه بیماران علامتدار که مبتلا به بیماری مزمن هستند، میباشند. همانطور که در بالا ذکر شد، شناسایی گونهها برای تصمیمگیری در مورد رژیم آنتیبیوتیک یا مدت زمان درمان ضروری نیست، اما سابتایپینگ در سطح سویه بیشتر میتواند برای تشخیص بیماری جدید از عود، بهویژه در کشورهای اندمیک مفید باشد. لوکوس ژنتیکی حاوی تعداد متغیری از نواحی تکراری پشت سرهم است که علیرغم شباهت زیاد جنسها از این نظر به هم T(VNTRs) اخیراً اثربخشی خود را در تایپینگ مولکولی گونههای بروسلا نشان دادهاند، بهعنوان یک نتیجه، یک تجزیه و تحلیل چندگانه VNTR بر اساس ۱۶ نشانگر (MLVA-۱۶) برای استفاده تشخیصی در بروسلوزیس انسانی پیشنهاد شده است. ژنوتیپهای مشابه MLVA-۱۶ از گونههای بروسلای جداشده از همان بیمار قبل و بعد از درمان اولیه ممکن است یک عود را تأیید کرده و تغییرات درمان مانند درمان طولانی مدت آنتیبیوتیک اعمال شود. در مقابل، اثر انگشتنگاری ژنتیکی ممکن است ژنوتیپهای مختلف را در مورد عفونت مجدد نشان دهد و درمان استاندارد بدون از دست رفتن اثربخشی میتواند تکرار گردد.
اهمیت تشخیص آزمایشگاهی در درمان
از آنجایی که درمان بروسلوزیس انسانی طولانی بوده و از داروهای متعدد با عوارض جانبی زیاد استفاده میشود، توصیههای درمانی باید به یک تشخیص آزمایشگاهی قطعی و دقیق تکیه کنند. اول از همه، افرادی که به صورت بالقوه در معرض بیماری هستند باید برای بروسلوز مورد آزمایش قرار بگیرند تا احتمال نتایج مثبت کاذب کاهش یابد. بیمارانی که نیاز به درمان دارند، باید قبل و بعد از درمان اولیه و در جریان پیگیری به روشنی تعریف شوند. اگرچه عفونت ممکن است در موارد عودکننده و مزمن ثابت شده باشد ولی معیارهای تشخیصی نباید ضعیف باشند.
یک فرد در صورتی بهعنوان یک بیمار دارای بروسلوزیس در نظر گرفته میشود که علائم بالینی و نشانههای بیماری را داشته و همچنین با تشخیص بالینی آزمایشگاه تأیید شده باشد (شکل ۱)؛ بهعنوان مثال، بروسلا را میتوان از خون، سایر مایعات بدن یا نمونههای بافت جدا کرد، تیتر آگلوتیناسیون اولیه بیش از ۱: ۱۶۰، Seroconversion و یا افزایش چهار برابر در تیتر آگلوتیناسیون در یک سرم تحت کنترل، یا تشخیص DNA بروسلا در یک نمونه بالینی.
در صورت جداسازی گونههای بروسلا از نمونههای بالینی باید اقدامات درمانی را بهسرعت آغاز کرد، بهویژه در مناطق اندمیک، ایزوله از محیط کشت باید در اولویت قرار گیرد تا تشخیص بالینی را تضمین کند، زیرا تفسیر تیترهای آنتیبادی آگلوتیناسیون میتواند با وجود تیترهای پایه بالاتر در جمعیت مخدوش شود. Cut off برای نتیجه مثبت آزمایش سرولوژی یک فرد به میزان زیادی بستگی به فرکانس تماس با سویههای بروسلا دارد. عفونتهای تکعلائمی و بدون علامت و عفونتهای خودمحدودشونده در بروسلوزیس انسانی شایعند. تیتر آنتیبادی IgG ضد بروسلایی ممکن است پس از گذشت زمان زیادی از تماس با عامل اتیولوژیک آن یا حتی بعد از درمان با آنتیبیوتیک بالا باقی بماند؛ بنابراین، نتایج آزمایش سرولوژیکی فقط باید بهعنوان دلیلی بر عفونت اخیر به همراه تاریخ در معرض قرار گرفتن تفسیر شوند. علاوه بر این، تجویز طولانی مدت آنتیبیوتیک بر اساس نتیجه آزمایش یک تست سرولوژیکی به نظر نمیرسد توجیه داشته باشد. برای یک تشخیص سرولوژیک قابل اعتماد از بروسلوزیس انسانی، حداقل دو آزمایش مختلف بر اساس یک روش بسیار حساس برای غربالگری و یک روش خاص برای تأیید نتیجه اولیه آزمایش لازم است.
تکنیکهای مولکولی مانند آزمایشهای Real-time PCR کمی ثابت کردهاند که کارآمدتر از روشهای معمول در تشخیص عفونتهای ناشی از میکروارگانیسمهای سخترشد مانند بروسلا هستند. تشخیص DNA بروسلا در نمونههای خون یا نمونههای بافتی بیماران دارای علائم که تاکنون درمان نشدهاند، ضرورت درمان آنتیبیوتیک را با وجود کشت منفی خون و یا آزمایشهای منفی سرولوژی نشان میدهد، درحالیکه بیماران بدون علامت با نتایج مثبت PCR باید از نظر زمینه بالینی دوباره ارزیابی شوند، اهمیت تشخیص DNA در بیماران درمانشده بروسلوزیس هنوز مبهم است.
دیدگاه کارشناسان و دیدگاه پنجساله
به علت عدم وجود یک آزمایش قابل اعتماد، بروسلوزیس انسانی یک بیماری با تشخیص مشکل است. کشت خون زمانبر و تستهای فنوتیپی متعاقب آن هنوز استاندارد طلایی تشخیص بروسلوزیس انسانی هستند. با این حال، بازده پائین کشتهای بروسلا، اغلب به تأخیر تشخیص و شروع درمان مناسب آنتیبیوتیک منجر میشود. سرولوژی یک وسیله مؤثرتر برای ارزیابی تشخیصی است، اگرچه عدم دسترسی به آزمایشهای استانداردشده در سطح بینالمللی، شیوع بالای آنتیبادیهای ضد بروسلا در کشورهای اندمیک، تداوم طولانی مدت آنتیبادیهای قابلتوجه بعد از درمان موفق، آنتیبادیهای متقاطع و غیره ممکن است تشخیص آزمایشگاهی را مختل کنند. نقاط cut off مناسب باید برای هر یک از سیستمهای سرولوژیک آزمایشگاهی و برای جوامع مختلف که از نظر اندمیک بودن متفاوت هستند، تعریف شود. مطالعات گسترده در مورد شیوع سرمی در یک جمعیت ممکن است به تعیین اهمیت نتایج مثبت آزمایشهای سرولوژی کمک کند. در آیندهای نزدیک، تکنیکهای مولکولی ممکن است انقلابی در تشخیص آزمایشگاهی بروسلوزیس انسانی ایجاد کند. تکنولوژی Real-time PCR با تمام الزامات تشخیص سریع آزمایشگاههای میکروبیولوژی بالینی مطابقت دارد. کاهش چشمگیر تأخیر تشخیصی، پیامدهای پیشآگهی مهمی بهخصوص در عوارض بیماری تهدیدکننده زندگی مانند نوروبروسلوز و اندوکاردیت بروسلائی دارد.
با این حال، معیارهای آزمایشگاهی اثبات عفونت فعال یا درمان قطعی نه برای سرولوژی و نه برای آزمایشهای مولکولی هنوز مشخص نشده است. مطالعات همبستگی تیترهای آنتیبادی یا مقدار DNA باکتریایی در نمونههای خون با یافتههای کشت و نتایج بالینی، بهعنوان مثال شدت بیماری، تمایل به عود و نیاز به درمان آنتیبیوتیک افزایش یافته، در حال حاضر کم است، علاوه بر این، آزمایشهای سرولوژیکی و مولکولی باید با توجه به مرحله بیماری در شرایط بالینی مجدداً تأیید شوند. دورههای پیگیری طولانی مدت برای تعیین اینکه آیا میزان آنتیبادیهای ضد بروسلا و مقدار DNA باکتریایی موقت است یا نشاندهنده ریشهکن شدن عامل اتیولوژیک بیماری است، موردنیاز است. در آخر باید توجه داشت که روشهای مولکولی نسبتاً گران هستند، به همین دلیل است که استفاده از آزمایشهای سرولوژی ممکن است برای آزمایشگاههای معمول در مناطق اندمیک که با وضعیت اجتماعی و اقتصادی ضعیف هستند، بیشتر باشد. برای این منظور، آزمونهای ارزان، ساده و سریع برای مراقبت از بیماران در کشورهای اندمیک ضروری است.
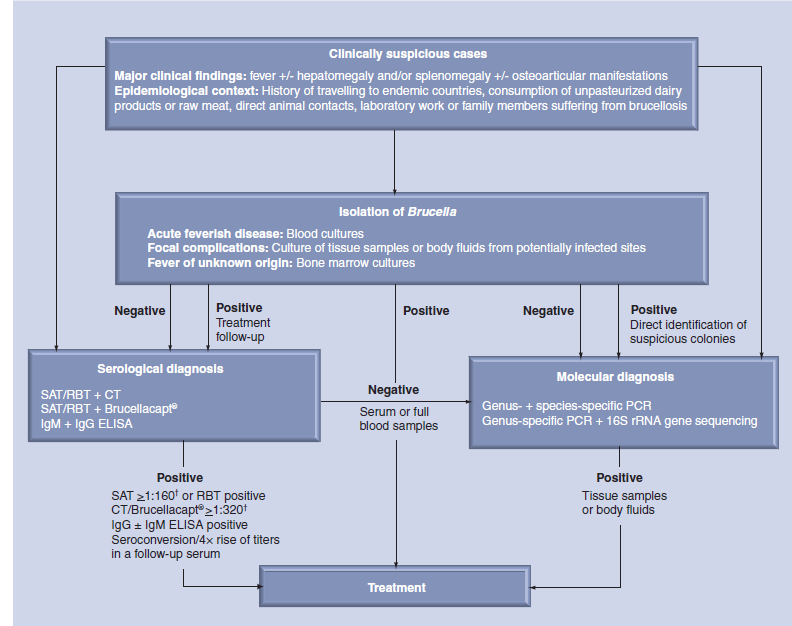
شکل ۱: درخت تصمیمگیری در تشخیص آزمایشگاهی بروسلوزیس انسانی
† مقادیر cut off میتواند در جمعیتهای مختلف و در بیماران بستگی به مرحله بیماری داشته باشد.
:CTآزمون کومبس؛ :RBTآزمون رز بنگال؛ :SAT تست آگلوتیناسیون سرم
فراپژوهش