هورمونهای تیروئید
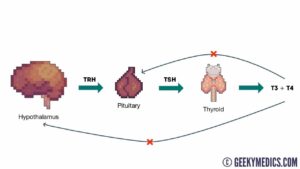
هورمون محرک تیروئید (Thyroid stimulating hormone) TSH
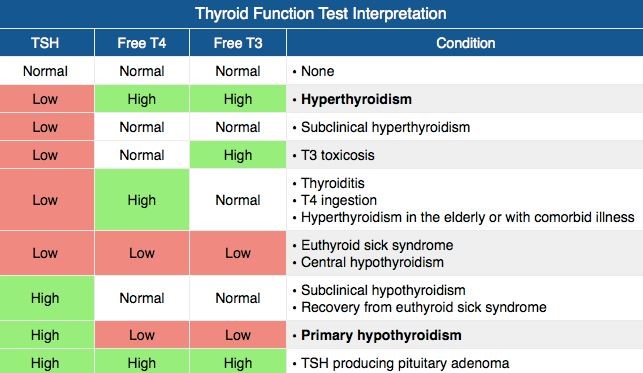
آزمایش TSH یکی از آزمایشهای روزمره است و گاهی ممکن است در مواردی از قبیل طوفان تیروئیدی، کومای میکس ادم و یا نارسایی ناشی از ورم میکس ادم بهصورت اورژانس درخواست گردد. غلظت TSH در سرم تغییرات روزانه دارد و افزایش آن در ساعات ۲ تا ۴ صبح و حداقل آن بین ساعتهای ۶ تا ۱۰ بعدازظهر است. در افراد با تیروئید سالم (euthyroid) با وجود تغییرات روزانه، سطح TSH در محدوده رفرانس قرار میگیرد.
فاکتور روماتوئید، آنتیبادیهای هتروفیل و پاراپروتئینها در سنجش ایمونولوژیک دخالت دارند. مشکل دیگر در تفسیر سطح TSH، مصرف خوراکی T۴ از منبع خارجی است که در این موارد عدم هماهنگی سطح آزاد T۴ با TSH مشاهده میگردد؛ برای مثال در بیمار مبتلا به کمکاری تیروئید اولیه که دارای کاهش سطح Free T۴ و افزایش سطح TSH است، تجویز خوراکی تیروکسین سطح FT۴ را بهسرعت در محدوده رفرانس قرار میدهد، درحالیکه سطح TSH ممکن است پس از چند هفته در محدوده نرمال قرار گیرد.
گزارشهایی از حضور ماکرو TSH با پیوند TSH به ایمونوگلوبین در دست است که به علت پاکسازی کند از جریان خون موجب افزایش کاذب سطح TSH میگردد. این موضوع بهویژه هنگامی که سطح آزاد T۳ و T۴نرمال ولی TSH بهطور غیرمعمول بالاست را بایستی مدنظر داشت.
برای برداشت این ماکرومولکولها از سرم میتوان از مهرههای آغشته به پروتئین A استفاده کرد.
گاهی عبور ماکرو TSH (IgG-TSH) از جفت موجب افزایش TSH در نوزاد و اشکال در تفسیر آن گردیده است و موجب میشود که شخص در دسته هایپوتیروئیدیسم سابکلینیکال قرار گیرد.
جهشهای ناکارآمد در زنجیره بتای مولکول TSH نیز شناخته شده است. در این موارد با تجویز FT۳ سطحTSH کاهش مییابد، درحالیکه اگر افزایش به علت ماکرو TSH باشد، تجویز T۳ از منبع خارجی قادر به پاکسازی TSH نیست.
صددرصد سطح T۴ در گردش خون منشأ تیروئیدی دارد، درحالیکه ۲۰ درصد سطح T۳ منبع تیروئیدی داشته و ۸۰ درصد آن در فرایند آنزیمی deiodination در بافتهای غیرتیروئید تولید میشود. حدود ۷۰ درصد از T۴ در پیوند با TBG (تیروکسین بایندینگ گلوبین) و ۲۰ درصد به ترانستیرتین (Transthyretin) و ۱۰% به آلبومین پیوند دارد و تنها ۰/۰۳ درصد و ۰/۳ درصد از T۴ و T۳ بهصورت آزاد و فعال در گردش هستند.
حدود ۵۰ درصد T۴ به T۳ و حدود ۴۰ درصد آن با برداشت گروه ید از حلقه داخلی مولــــکول به rT۳ (Reverse T۳) تبدیل میگردد که از نظر بیولوژیک فعال نیست و نیمهعمر چهارساعته دارد. سطح rT۳ در بیماریهای غیرتیروئیدی، استرس و بیماریهای شدید افزایش مییابد. افزایش سطح آن در مصرف آمیدارون و پروپانول مشاهده شده است.
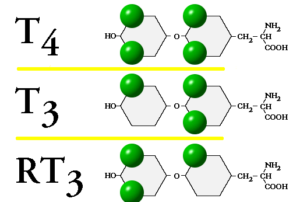
فرایند تبدیل T۴ به T۳ و rT۳در شکل فوق مشاهده میشود. گوی سبز رنگ به موقعیت ید در ساختار هورمونی اشاره میکند
آنتیبادیهای ضدتیروئید از قبیل آنتی TPO، آنتی (Anti-Thyroglobulin) Tg و آنتیبادی علیه گیرنده TSH مسئول تهاجم سلولهای T به سلولهای تیروئید و تخریب و التهاب است. آنتی (Anti-Thyroid Peroxidase) TPO در پروسه تخریب بافت تیروئید شرکت دارد که نتیجه آن کمکاری التهابی هاشیموتو و آتروفیک بافت تیروئید است.
آنتیبادی علیه Tg در سنجش تیروگلوبولین دخالت دارد و قبل از سنجش Tg بایستی آنتی Tg را مورد ارزیابی قرار داد. آنتیبادی علیه گیرنده TSH ممکن است تحریکی یا مسدودکننده باشد؛ برای مثال در گریوز تحریککننده است و موجب پرکاری تیروئید میشود.
هورمونهای T۳ و T۴ بهطور عمده به TBG پیوند دارند. اندازهگیری سطح TBG در مواردی که سطح سرمی T۳ و T۴ با شرایط بالینی بیمار مطابقت ندارد مورد سنجش قرار میگیرد. سطح نرمال آن در طیف ۱۳ تا ۳۹ میکروگرم در دسیلیتر یا ۱۵۰ تا ۳۶۰ نانومول در لیتر با روشهای ایمونولوژیک است. کاهش ارثی و واریانتهای با میل ترکیبی کم برای T۳ و T۴ شناخته شده است.
 |  |
شکل سمت چپ: تفسیر آزمایشهای تیروئیدی
شکل سمت راست: برای تشخیص بیماریهای تیروئید از سنجش هورمونهای تیروئیدی، آنتیبادیهای ضد پراکسیداز تیروئیدی (Anti TPO) و تیروگلوبولین (Anti TG) و سونوگرافی و علائم بالینی استفاده میشود
 |  |
سطح ایدهآل هورمونها و آنتیبادیهای ضدتیروئیدی در یک شخص سالم و تغییرات سطح آن در کمکاری و پرکاری اولیه و ثانویه
داروهایی از قبیل سالیسیلات، فنیتوئین، پنیسیلین و هپارین قادر به جدا کردن T۴ از TBG هستند. در نوزادان چنانچه سطح TSH کمتر از mIU/L ۱۰ باشد نیاز به پیگیری نیست و اگر بین ۱۰ تا ۲۰ باشد نیاز به تکرار در ۲ تا ۶ هفتگی است و چنانچه سطح TSH با blood spot اولیه بیشتر ازmIU/L ۲۰ باشد ارزیابی آزمایشگاهی برای کمکاری تیروئید سفارش میشود. سطح آستانه برای تشخیص کمکاری تیروئید در نوزادان با توجه به کیت و روش آزمایشگاهی ممکن است متفاوت باشد.
بیماریهای شدید غیرتیروئیدی که در آن سطح T۴ زیر ۲ نانوگرم بر دسیلیتر قرار میگیرد دارای پیشآگهی نامطلوب هستند. در این بیماران افت سریع میزان توتال و آزاد T۳ نیز رخ داده، در حالی بافت تیروئید سالم است و از این رو به این حالت سندروم Euthyroid sick گفته میشود. در حاملگی افزایش سطح استروژن موجب افزایش تدریجی غلظت TBG میگردد و در ۱۶ هفتگی میزان توتال T۳ و T۴یک و نیم برابر محدوده رفرانس طبیعی نسبت به خانمهای غیرحامله است. با وجود افزایش سطح میزان توتال T۳ و T۴، سطح آزاد هورمونها طبیعی است.
با توجه به اینکه هورمون HCG از نظر ساختاری شبیه TSH است، تحریک غده تیروئید و افزایش اندک FT۴ و T۳ و کاهش TSH در سه ماهه اول حاملگی را به دنبال دارد و مقدار زیر نرمال TSH در حدود ۲۰ درصد مادران که حاملگی طبیعی دارند مشاهده میگردد.
اوج افزایش HCG و کاهش TSH در حدود هفته ۱۰ تا ۱۲ حاملگی رخ میدهد. در حدود ۲ درصد از خانمهای حامله افزایش FT۴ چشمگیر بوده که از آن به تیروتوکسیکوز موقت حاملگی یاد میشود که با استفراغ زیاد حاملگی همراه میشود. میزان رفرانس TSH در رابطه با سه ماه اول تا سوم حاملگی به شرح زیر گزارش شده است:
- سطح ۰/۱ تا ۲/۵ برای سه ماهه اول،
- ۰/۲ تا ۲/۵ برای سه ماهه دوم،
- ۰/۳ تا ۳ برای سه ماهه سوم

نوسان سطح هورمونهای تیروئیدی در حاملگی
داروها نهتنها قادر به اثرگذاری روی هورمونهای تیروئید در داخل گردش خون هستند، بلکه روی آزمایشهای تیروئید دخالت میکنند. افزایش استروژن موجب افزایش TBG شده که به دنبال آن افزایش توتال T۴ وT۳ مشاهده میشود. دارو بر سطح TSH و T۴ و T۳ آزاد اثری ندارد.
داروهای استروئیدی در میزان بالا نهتنها سطح TSH را سرکوب میکنند، بلکه تبدیل T۴ به T۳ را نیز کاهش میدهند. دوپامین با سرکوب TSH مانع از تشخیص کمکاری تیروئید در بیماران بستری میشود که انتظار افزایش آن هست. پروپانولول سرکوبکننده تبدیل T۴ به T۳ است و از همین رو در درمان تیروتوکسیکوز از آن استفاده میشود.
آیودید (Iodide) موجود در مواد حاجب عکسبرداری که در سیتیاسکن، آنژیوگرافی و یا حتی ضدعفونی کردن پوست بهکار میرود ممکن است در افراد مستعد موجب کمکاری یا پرکاری تیروئید گردد. داروهای حاوی ید مانند آمیدارون که بهعنوان داروی ضد آریتمی قلب بهکار میروند میتوانند در ۱۰ درصد بیماران موجب کمکاری و در یک تا دو درصد افراد حساس با پرکاری تیروئید با مثبت شدن Anti TPO همراه شوند.
داروی سوماتوستاتین یا آنالوگ آن که در درمان آکرومگالی بهکار میروند و نیز دوپامین از سنتز TSH جلوگیری کرده و در مبتلایان به بیماری شدید غیر تیروئید ممکن است این سرکوب به حدی باشد که TSH قابل تشخیص نباشد.
لیتیوم از سنتز و رها شدن هورمونهای تیروئیدی جلوگیری کرده و در ۱۵ تا ۵۰ درصد بیماران با کمکاری تیروئید بهویژه در آن دسته که Anti TPO مثبت، مشاهده میشود. سازوکار لیتیم شبیه به آیودید است. لیتیم در غده تیروئید تراکم یافته و از جذب ید و از جفت شدن ید به تیروزین جلوگیری میکند.
داروهایی از قبیل فنیتوئین، کاربامازپین، سالسیلات و فوروزماید بهصورت رقابتی با هورمونهای تیروئیدی برای پیوند با پلاسمای پروتئین عمل میکنند، از این رو کاهش سطح توتال T۴ را بهدنبال دارند، درحالیکه سطح FT۴ در محدوده نرمال نگه داشته میشود. هپارین با فعال کردن آنزیم لیپاز موجب افزایش اسیدهای چرب آزاد گشته که با پیوند T۴ به پروتئین رقابت کرده و موجب افزایش FT۴ میگردد.
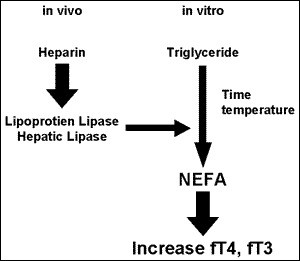
اثرات تجویز هپارین روی سطح هورمونهای تیروئیدی مشاهده میشود. هپارین با فعال کردن آنزیم لیپاز و تولید اسیدهای چرب موجب ایجاد رقابت در پیوند هورمونهای تیروئیدی به پروتئینها میگردد
درمان با فنوباربیتال، فنیتوئین، ریفامپین و کارمابازاپین موجب افزایش سرعت پاکسازی هورمونهای تیروئید از طریق تبدیل T۴ به T۳ میگردد، از این رو در بیمارانی که کمکاری تیروئید داشته و روی درمان با داروهای فوق هستند پیگیری سطح دارو اساسی است، زیرا ممکن است به دوز اضافی تیروکسین نیاز داشته باشند و از طرفی پرکاری تیروئید متابولیسم داروهایی مانند فنوباربیتال را تسهیل میکند و از این رو پیگیری با آزمایش TSH و FT۴ ضروری است.
دوز ایدهآل داروی تیروکسین برای بیماران مبتلا به کمکاری تیروئید سطح TSH بین ۵/۰ تا ۲ میکرو واحد در میلیلیتر است. به دنبال تغییر در دوز تیروکسین حداقل ۶ هفته لازم است تا TSH مجدد آزمایش شود. آزمایش سالانه TSH برای بیمارانی که روی دوز یکنواخت دارو هستند، سفارش میشود. چنانچه نیاز به سنجش FT۴ است، بایستی از خوردن تیروکسین در روز آزمایش خودداری شود، زیرا سطح آزاد T۴ حدود ۱۳ درصد برای ۹ ساعت بعد از آخرین دوز خوراکی افزایش مییابد. داروی تیروکسین بایستی قبل از غذا هر روز در همان ساعت و حداقل با ۴ ساعت فاصله از داروهای دیگر و ویتامینها مصرف شود.
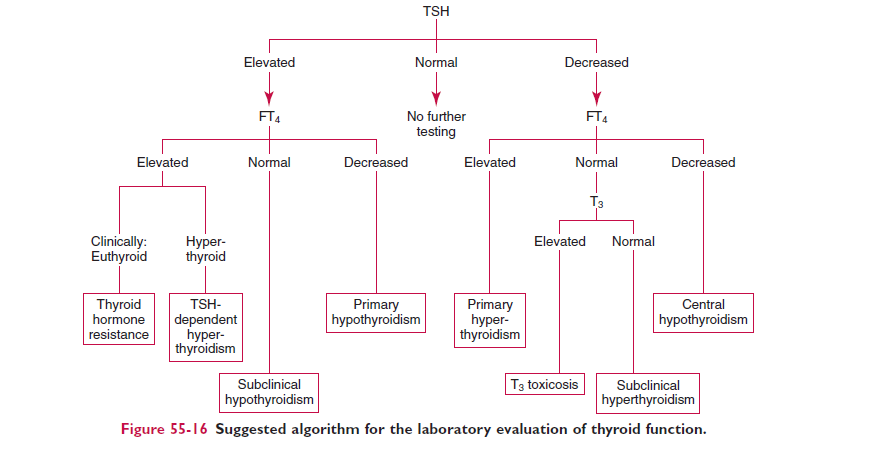
الگوریتم تشخیص بیماریهای تیروئید با سنجش TSH، FT۴ و T۳
پرولاکتین
پرولاکتین یک پلیپپتید است که از سلولهای لاکتوتروف غده هیپوفیز ترشح گردیده و عهدهدار شروع و نگهداری شیردهی است. در شرایط عادی ترشح آن تحت اثر بازدارندگی دوپامین در سطح پایین قرار دارد. ترشح پرولاکتین همانند اکثر هورمونهای هیپوفیز دارای ترشح ریتمیک است و بیشترین سطح ترشح آن در طی خواب و کمترین آن بین ۱۰ صبح تا شب است. ترشح پرولاکتین نهتنها بهصورت نبضی در طول روز است، بلکه تحت اثر محرکهای فیزیولوژیک مانند استرس، درد، خوردن، شیردهی و غیره قرار میگیرد.

با توجه به عوامل فوق و نیمهعمر ۲۶ تا ۴۷ دقیقهای هورمون، برخی پیشنهاد میکنند که برای سنجش سطح آن سه نمونه در فواصل ۲۰ تا ۳۰ دقیقهای تهیه شود و جداگانه یا بهصورت پولدشده آنالیز گردند. بههرحال سنجش تک نمونهای که سطح آن با توجه به جنس بالاتر از نرمال باشد دارای اهمیت بوده و سطح بیشتر از ۲۵۰ میکروگرم در لیتر معمولاً بیانگر پرولاکتینمی است.
بخش عمده پرولاکتین در گردش خون بهصورت منومر غیرقندیشده است ولی فرمهای دیگر آن بهصورت پرولاکتین بزرگ و خیلی بزرگ در پیوند با ایمونوگلوبولینها نیز یافت میشود و همهی فرمها در سنجش ایمنواسی شرکت میکنند؛ درحالیکه فرمهای بزرگ و خیلی بزرگ فعالیتی ندارند، ولی موجب افزایش سطح پرولاکتین در شخصی میگردند که علائم بالینی یا رادیولوژی در رابطه با افزایش سطح مشاهده نمیشود. استخراج با پلیاتیلن گلایکول و استفاده از سانتریفیوژ اولترا جهت کاهش تداخل ماکروپرولاکتین بهکار میرود. سطح پرولاکتین در رابطه با سایز تومور (پرولاکتینوما) است ولی رخداد پدیده هوک کاهش کاذب را بهدنبال دارد و ممکن است مشکل تشخیصی یک آدنوم کروموفوب غیرفعال بهجای یک تومور فعال را برای پزشک ایجاد کند.
 |  |
نقش فیزیولوژیک پرولاکتین و عوامل کنترلکننده ترشح آن
پدیده هوک در سنجش ایمونولوژیک یک مرحلهای الایزا رخ میدهد. در این گونه سنجش یک آنتیبادی علیه پرولاکتین به فاز جامد چسبیده و آنتیبادی دوم که علیه اپیتوپ دیگر پرولاکتین است به پروب آنزیمی یا فلورسانس یا کمی لومینسانس متصل است. با به دام افتادن پرولاکتین بین دو آنتیبادی، ارسال سیگنال برای سنجش هورمون داده میشود. چنانچه مقدار پرولاکتین زیاد باشد مقدار کمتری به آنتیبادی فاز جامد چسبیده و بیشتر آن توسط آنتیبادی نشاندار پیوند خورده و از محیط خارج میگردد و در نتیجه سیگنال کمتری ارسال میشود. شستشو قبل از اضافه کردن آنتیبادی دوم و یا سنجش ایمونولوژیکی هموژن اثرات هوک را کاهش میدهد و در موارد مشکوک سفارش میشود که سرم ۱۰۰ برابر یا گاهی هزار برابر رقیق شود.
پرولاکتین از ترشح هورمون گنادوتروپین جلوگیری کرده و از این رو موجب کاهش و رها شدن هورمونهای LH و FSH از غده هیپوفیز میگردد که در خانمها کاهش سطح استروژن و پروژسترون و عدم وجود فولیکولهای تخمدان را بهدنبال دارد. کاهش سنتز FSH و LH در مردها موجب کاهش تستوسترون شده که اختلال تولید اسپرم را به دنبال دارد.
سطح مرجع پرولاکتین ۱ تا ۲۵ میکروگرم در لیتر برای خانمها و ۱ تا ۲۰ میکروگرم در لیتر برای آقایان است. در حاملگی افزایش تدریجی در سطح پرولاکتین مشاهده گردیده و تا ۵۰۰ میکروگرم در سه ماهه سوم گزارش شده است. سطح پرولاکتین به شرطی که شیردهی به نوزاد قطع شود، در سه هفته به سطح پایه برمیگردد.
افزایش سطح پرولاکتین در نتیجه استرسهای فیزیولوژیک و داروها بهندرت بیشتر از ۲۰۰ میکروگرم در لیتر میشود. افزایش پرولاکتین در ۲۰ تا ۴۰ درصد موارد اکرومگالی ناشی از تومورهای همزمان لاکتوتروف و سوماتوتروف مشاهده میشود. یکی دیگر از موارد مهم افزایش پرولاکتین، کمکاری تیروئید است. هورمون تیروتروپین (TRH) نهتنها موجب ترشح TSH میشود بلکه موجب ترشح پرولاکتین هم میگردد، از این رو اندازهگیری TSH و T۴ در شخصی که افزایش پرولاکتین دارد سفارش میشود. در پیگیری پرولاکتینمی به انجام آزمایشهای CT و امآرآی از هیپوفیز (SELLA) و نیز معاینه چشمی (Visual field) سالانه سفارش جدی میگردد.
برخی از علل افزایش پرولاکتین به غیر از تومورهای سلولهای تولیدکننده پرولاکتین عبارتند از:
- خواب، استرس، درد، تماس جنسی، آسیب به سینه، کمکاری تیروئید
- نارسایی آدرنال، سیروز کبدی، نارسایی مزمن کلیه
- داروهای اعصاب از قبیل فنوتیازین، هالوپریدول، تیوزانتین، دومپریدون، تریپتیلین و فلوکستین
- داروهایی مانند متوکلوپروماید، وراپامیل، متیلدوپا، رانیتیدین، سایمتیدین
- هروئین، متادون، مورفین
- تزریق TRH
- تشنج
- تخمدان پلیکیستیک